
【题目】在强酸性溶液中可发生如下反应:2Mn2++5R2O8 x-+8H2O==16H++10RO42-+2MnO4-,这个反应可定性地检验Mn2+的存在,在反应中充当氧化剂的R2O8x-中,x的值是 ( )
A.0B.1C.2D.3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题:
(1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。
(2) 已知:①X的单质结构为( ,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(
,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为( ,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。
②有关键能的数据如下表:
化学键 | X-O | O=O | X-X |
键能(kJ/mol) | 460 | 498.8 | 176 |
写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式)
(3) 写出Z的单质与H2O反应的化学方程式_____________________________________。
(4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
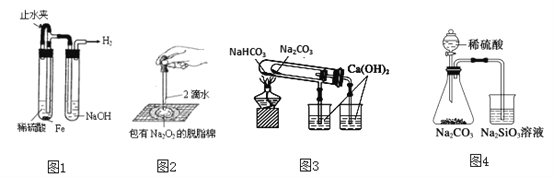
A. 图1:制备并观察氢氧化亚铁
B. 图2:证明过氧化钠与水反应放热
C. 图3:验证NaHCO3和Na2CO3的热稳定性
D. 图4:验证酸性强弱H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
A. Na2O+H2O=2NaOH B. Cl2+H2O=HCl+HClO
C. C+H2O=CO+H2 D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na +2H2O![]() Na++2OH– + H2↑
Na++2OH– + H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O![]() H2↑+Cl2↑+2OH–
H2↑+Cl2↑+2OH–
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + ![]()
![]() BaSO4↓+H2O
BaSO4↓+H2O
D. SO2溶于水显酸性:SO2 + H2O == 2H+ + SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学设计实验,完成了![]() 和
和![]() 溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
溶液的反应,在检验反应后的溶液中是否存在Fe3+时发现实验现象出乎预料,并通过实验进行探究。
实验I:
| 实验现象 |
i.加入 ii.取少量i中清液于试管中,滴加2滴1 mol/L |
已知:i.![]()
ii.![]() 的性质与卤素单质相似,且氧化性:
的性质与卤素单质相似,且氧化性:![]()
(1)![]() 和
和![]() 溶液反应的离子方程式是______。
溶液反应的离子方程式是______。
(2)现象ii中溶液最终呈红色的一种可能原因是:![]() 和
和![]() 生成(SCN)2,进而使清液中的
生成(SCN)2,进而使清液中的![]() 氧化为
氧化为![]() 。设计如下实验II进行验证:
。设计如下实验II进行验证:

① 认为原因被证实的现象iii是________。
② 加入CuCl2溶液后反应的离子方程式是_________。
(3)有的同学认为实验II并不严谨,不能证实(2)中猜想,改进的实验III如下:

① 对比实验II,说明实验III更加严谨的原因:________。
② 改进后的实验才能证实(2)中猜想,依据的上述现象是______。
(4)改变实验I的试剂添加顺序及用量,设计实验IV:
实验IV | 现象 |
向2 mL 1 mol/L | 充分振荡,溶液红色褪去,有白色沉淀生成 |
① 实验IV中溶液红色褪去,不能说明![]() 反应完全。结合实验II或III,说明理由:_______。
反应完全。结合实验II或III,说明理由:_______。
②实验小组同学进行讨论,设计了下列实验方案,能够检测红色褪去后的溶液是否含有![]() 的是_______(填序号)。
的是_______(填序号)。
a.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
b.排除溶液中的![]() 后,再加入足量
后,再加入足量![]() 溶液进行检测
溶液进行检测
c.选择一种只与![]() 反应的试剂,观察是否出现特征现象
反应的试剂,观察是否出现特征现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是

A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com