
【题目】下列说法不正确的是
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液
【答案】C
【解析】
A.Na与H2O的反应是固体液体反应生成气体,故该反应为熵增的反应,故△S﹥0,在反应中钠会熔化成一光亮的小球四处游动,发出咝咝声响,故该反应为放热反应,则△H﹤0,故△G=△H-T△S﹤0,故该反应能自发进行,A正确;
B.饱和Na2SO3溶液或浓硝酸均可使蛋白质溶液产生沉淀,Na2SO3为钠盐,故饱和Na2SO3溶液使蛋白质溶液产生沉淀是蛋白质的盐析,而浓硝酸为氧化性强酸,故使蛋白质溶液产生沉淀是蛋白质变性,二者原理不同,故B正确;
C.FeCl3和MnO2均可做H2O2分解的催化剂,加快H2O2分解,同等条件下二者对H2O2分解催化效果不相同,故反应速率的改变不同,故C错误;
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),NH4Cl溶液NH4+水解使溶液呈酸性,会消耗OH-,则Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),NH4Cl溶液NH4+水解使溶液呈酸性,会消耗OH-,则Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq)正向移动,故固体Mg(OH)2可溶于NH4Cl溶液,D正确;
Mg2+(aq)+2OH-(aq)正向移动,故固体Mg(OH)2可溶于NH4Cl溶液,D正确;
答案选C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中
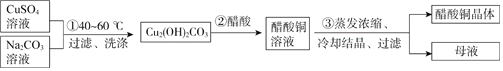
(1)用离子方程式表示过程①产物中OH-的来源:___________;
(2)过程②对应的化学方程式是:___________。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2![]() +I2=
+I2=![]() +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________;
(4)醋酸铜产品中铜元素的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作及现象 | 结论 |
A | 加入AgNO3溶液,生成白色沉淀,再加稀盐酸沉淀不溶解 | 原溶液中有Cl-存在 |
B | 通入Cl2后,溶液变为深黄色,继续加入淀粉溶液后溶液变蓝 | 原溶液中有I-存在 |
C | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时 | 原溶液中有 |
D | 加入稀盐酸,生成的气体能使澄清石灰水变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )
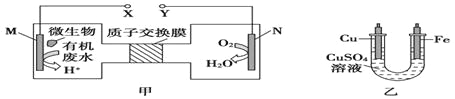
A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:
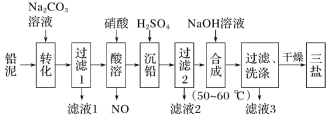
已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是__。
(2)酸溶时,不直接使用H2SO4溶液的原因可能是__;铅与硝酸在酸溶过程中发生反应的离子方程式为__。
(3)流程中可循环利用的物质是__;洗涤操作时,检验沉淀是否洗涤干净需要的试剂是__。
(4)当沉淀转化达平衡时,滤液l中c(![]() )与c(
)与c(![]() )的比值为__。
)的比值为__。
(5)50~60℃时合成三盐的化学方程式为__;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5 ℃,沸点-24.9 ℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) =CH3OCH3(g)+H2O(g) ΔH1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g) ![]() CH3OH(g) ΔH2=-90.7 kJ·mol-1
CH3OH(g) ΔH2=-90.7 kJ·mol-1
③2CH3OH(g) ![]() CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3 kJ·mol-1、1 453.0 kJ·mol-1;1 mol液态水变为气态水要吸收44.0 kJ的热量。反应③中的相关的化学键键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E (kJ · mol-1) | 436 | 343 | 465 | 453 | 413 |
则ΔH1=______kJ·mol-1;ΔH3=______ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4)∶n(O2)=2∶1混合,能正确反映反应①中CH4 的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
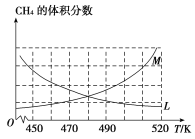
A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变
(3)有人模拟制备原理Ⅱ,在500 K时的2 L的密闭容器中充入2 mol CO和6 mol H2,8 min达到平衡,平衡时CO的转化率为80%,c(CH3OCH3)=0.3 mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500 K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)_________v(逆),说明原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
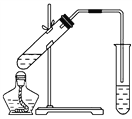
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
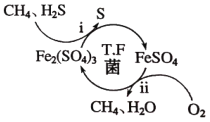
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用具有重要的社会意义。回答下列问题:
(1)CO可用于高炉炼铁,已知:
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) △H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) △ H2= b kJ/mol
则反应Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)的△H=________kJ/mol
(2)某温度下,在容积为2 L的密闭容器甲中投入8molCO2(g)、16molH2(g)发生反应:
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
甲容器15 min后达到平衡,此时CO2的转化率为75%。则015 min内用二氧化碳表示平均反应速率v(CO2)=_______,计算此条件下该反应的平衡常数K= __________。
(3)捕碳技术是指从空气中捕获二氧化碳的各种科学技术的统称。目前NH3和(NH4)2CO3等物质已经被用作工业捕碳剂。
①下列物质中不可能作为CO2捕获剂的是___________。
A.Na2CO3 B.NaOH C.CH3CH2OH D.NH4Cl
②用(NH4)2CO3捕碳的反应:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2效率的影响,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,保持其它初始实验条件不变,分别在不同温度下,经过相同时间测得CO2气体浓度,得到趋势图:
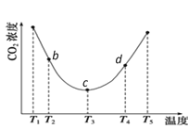
I. c点的逆反应速率和d点的正反应速率的大小关系为
V逆c _____V正d (填“>”、“=”或“<”)
II. b、c、d三点的平衡常数K b 、K c、 Kd 从大到小的顺序为_______。(填“>”、“=”或“<”)
III.T3~T4温度区间,容器内CO2气体浓度呈现增大的变化趋势,其原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com