

| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 3 |
| 0.01944g |
| 0.0200g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Ba2+、Mg2+、Cl-、CO32- |
| B、Fe3+、K+、I-、SO42- |
| C、K+、NH4+、NO3-、OH- |
| D、Al3+、NH4+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氧化还原是常见的反应类型,根据信息回答以下问题:
氧化还原是常见的反应类型,根据信息回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
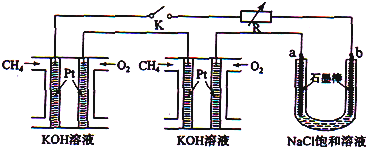
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
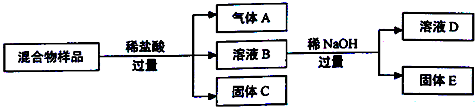
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com