
 .
. 分析 马来酸酐可由马来酸分子内脱水制得.马来酸酐分子中含有五个原子构成的环状结构,马来酸的相对分子质量为116,实验式为CHO,令马来酸的组成为(CHO)n,则29n=116,则n=4,则马来酸的分子式为C4H4O4,不饱和度=$\frac{4×2+2-4}{2}$=3,马来酸酐可由马来酸分子内脱水制得.马来酸酐分子中含有五个原子构成的环状结构,分子中含有2个-COOH,则马来酸分子中还含有C=C,其核磁共振氢谱显示有两个波峰,分子种含有2种H原子,面积比为1:1,则2种H原子的数目分别为2、2,则马来酸为HOOCCH=CHCOOH.
解答 解:马来酸酐可由马来酸分子内脱水制得.马来酸酐分子中含有五个原子构成的环状结构,马来酸的相对分子质量为116,实验式为CHO,令马来酸的组成为(CHO)n,则29n=116,则n=4,则马来酸的分子式为C4H4O4,不饱和度=$\frac{4×2+2-4}{2}$=3,马来酸酐可由马来酸分子内脱水制得.马来酸酐分子中含有五个原子构成的环状结构,分子中含有2个-COOH,则马来酸分子中还含有C=C,其核磁共振氢谱显示有两个波峰,分子种含有2种H原子,面积比为1:1,则2种H原子的数目分别为2、2,则马来酸为HOOCCH=CHCOOH.
①由上述分析可知,马来酸的分子式为 C4H4O4,故答案为:C4H4O4;
②马来酸为HOOCCH=CHCOOH,含有C=C双键,能发生消去反应、加聚反应、氧化反应,含有羧基,能发生酯化反应,不能发生消去反应与水解反应,
故答案为:ce;
③马来酸为HOOCCH=CHCOOH,分子内脱水制得马来酸酐结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,需要学生对给予想信息进行利用,能较好的考查考生的阅读、自学能力和思维能力,掌握官能团的性质是解题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中,这些离子不可大量共存:Cl-,S2-,SO32-,K+ | |
| B. | 向CH3COOH溶液中滴加NaOH的过程中,计算式$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值始终不变 | |
| C. | 苯酚钠溶液中通入少量CO2,发生反应:2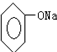 +H2O+CO2→2 +H2O+CO2→2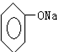 +Na2CO3 +Na2CO3 | |
| D. | 硝酸亚铁溶液中滴入盐酸的离子反应方程式为:3Fe2++4H++NO3-═3Fe3++NO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 为预防碘缺乏病,在食盐中加入碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 在8.12天津大爆炸中消防员喷洒双氧水以防止氰化钠污染环境:CN-+H2O2+H2O═HCO3-+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 属于同种元素 | B. | 属于同位素 | C. | 属于同种核素 | D. | 属于同种原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.
CH3COO-(aq)+H+(aq)△H=+0.3 kJ/mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com