
【题目】(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________、_______。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:
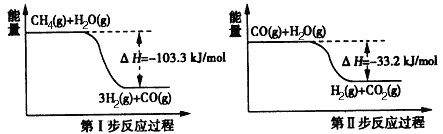
甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________。
【答案】 正极:O2 + 4e- +2H2O = 4OH- 负极:Fe - 2e- = Fe 2+ CH4 (g)+ 2H2O(g) = CO2(g) +4H2(g) △H=-136.5KJ/mol 2NH3(g) +CO2(g) = CO(NH2)2(g) +H2O(g) △H=-87.0KJ/mol 2NH3 -6e- +6OH- = N2 + 6H2O
【解析】(1)钢铁发生吸氧腐蚀时,铁作负极,发生失电子的氧化反应,即Fe=Fe2++2e-,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:负极:Fe=Fe2++2e-,正极:2H2O+O2+4e-=4OH-;:
(2)根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3KJ/mol;根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol;根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol,故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol;
(3)①2NH3(g)+CO2(g)→NH2CO2 NH4(s)△H=-l59.5kJ/mol,②NH2CO2NH4(s)→CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol,③H2O(l)→H2O(g)△H=+44.0kJ/mol,依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJmol-1;故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJmol-1;
(4)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O,故答案为:2NH3-6e-+6OH-=N2+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 拆开物质中的化学键一定需要吸收能量
C. 应用盖斯定律,无法计算某些难以直接测量的反应焓变
D. 化学反应都伴随着能量变化和其他各种现象的出现
查看答案和解析>>
科目:高中化学 来源: 题型:
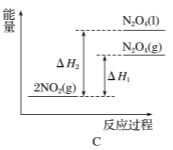
【题目】(1)已知:2NO2(g)![]() N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g) ![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是 (填字母)。

(2)下图所示是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为
。反应中如果加入1 mol氮气和3 mol氢气,反应放出的能量 (填“大于”“等于”或“小于”)92 kJ,原因是 。

(3)室温下,1 g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8 kJ的热量。写出C6H6燃烧的热化学方程式: 。
(4)已知:H2(g)+Cl2(g)===2HCl(g) ΔH=185 kJ·mol1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
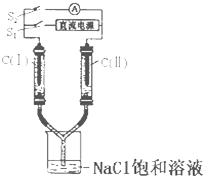
①接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中均有气体生成。则电极C(Ⅰ)是_____极(填“阳”或“阴”);C(Ⅱ)电极反应所得气体产物为_____________。
②通电一段时间后(玻璃管中液面未脱离电极), 断开S1,接通S2,电流表的指针发生偏转,此时电极C(Ⅰ)为____(填“正”或“负”)极;C(Ⅰ)的电极反应为______。
(2)若用此装置精炼粗铜,断开S2接通S1电解液选用CuSO4溶液;粗铜接电池的_______(填“正”或“负”)极,阴极发生的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究液体X[仅含两种元素,100g·mol-1]的组成和性质,设计并完成如下实验:
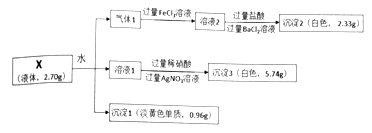
请回答:
(1)化合物X的化学式为_______________。
(2)将气体1通入FeCl3溶液中,溶液由黄色变成浅绿色,且酸性明显增强。写出该反应的离子方程式_________________。
(3)写出液体X与水反应生成气体1、溶液1和沉淀1的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B. 胶体的本质特征是丁达尔效应
C. 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D. 宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知为使Fe3+、Fe2+、Zn2+较完全地形成氢氧化物沉淀,溶液的pH分别为3.7、9.6、4.4左右。某酸性硫酸锌溶液中含有少量Fe3+、Fe2+,为除去这些离子得到纯净的硫酸锌,应加入的试剂是
A. Cl2、ZnCO3 B. 氨水 C. H2O2、ZnO D. NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com