
| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子的最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |


科目:高中化学 来源: 题型:
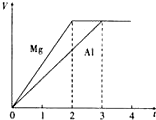 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍 |
| B、中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙) |
| C、物质的量浓度c(甲)>10c(乙) |
| D、甲中的c(OH-)为乙中的c(OH-)的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
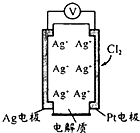 利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体
利用如图所示原电池可测量空气中Cl2含量,其中电解质是Ag+可以自由移动的固体| A、电子经外电路流向Pt电极 |
| B、电池工作时,电解质中Ag+数目减少 |
| C、正极反应:C12+2e-+2Ag+=2AgCl |
| D、空气中c(C12)越大,Ag极消耗速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 I-+Cl2→I2+2Cl- |
| B、2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- |
| C、2Fe2++4I-+3Cl2→2Fe3++2I2+6Cl- |
| D、2Fe2++6I-+4Cl2→2Fe3++3I2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、1:1 |
| C、2:3 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、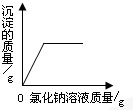 向一定量的硝酸银溶液中逐滴加入氯化钠溶液 |
B、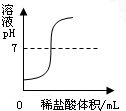 向一定量的氢氧化钠溶液中逐滴加入稀盐酸 |
C、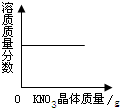 向t℃的饱和硝酸钾溶液中加入一定量的硝酸钾晶体 |
D、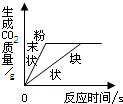 等质量的碳酸钙分别与等体积等质量分数的足量稀盐酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com