
下列分子或离子在指定条件的分散系中能大量共存的是
A. Ca(NO3) 2溶液中: Fe2+、H+、Cl—、SO42—;
B.使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32-;
C.水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、HCO3—、CH3COO-[;
D.透明的强酸性溶液中: Al3+、Fe3+、Cl-、SO42
科目:高中化学 来源: 题型:
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多,上述盐酸溶液的浓度为( )
A.0.5 mol/L B.1.0 mol/L
C.2.0 mol/L D.3.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
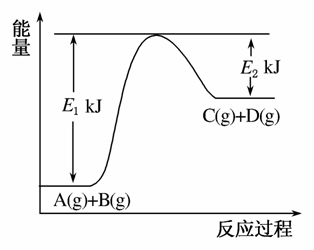
)已知某反应A(g)+B(g)C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列说法正确的是
A.M与X形成的化合物对应的水化物一定是强酸
B.Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C.X、Y的简单离子半径:r(X2-)>r(Y+)
D.M的气态氢化物比N的气态氢化物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如右图。
(1)柠檬酸的晶体类型为 。
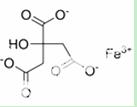 (2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为
(填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2在反应中只作氧化剂
B.O2是还原产物
C.2molFeSO4发生反应时,反应中共有8mol电子转移
D.Na2FeO4既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,
其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com