
离子晶体一般不具有的特征是( )
A.熔点较高、硬度大
B.易溶于水而难溶于有机溶剂
C.干燥时不能导电
D.熔化时不导电
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。
工业上制备无水FeCl3的一种工艺如下:
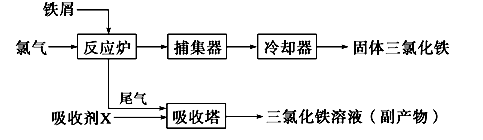
 (1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为_________________________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 (g/100 g H2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10- 36 ) 。
36 ) 。
(4)吸收剂X是______________________;吸收塔中吸收剂X的作用是_________________________________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2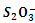
 2I-+
2I-+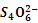 ),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
),共用去V mL。则样品中氯化铁的质量分数为 __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤代烃能发生下列反应:2CH3CH2Br+2Na—→CH3CH2CH2CH3+2NaBr。下列有机物可合成环丙烷(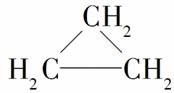 )的是( )
)的是( )
A.CH3CH2CH2Br B.CH3CHBrCH2Br
C.CH2BrCH2CH2Br D.CH3CHBrCH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
①~④是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
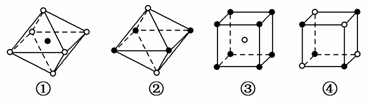
A.图①和③ B.图②和③
C.只有④ D.图①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有____________________________。
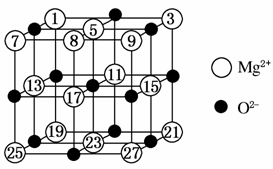
(2)已知MgO的晶体结构属于NaCl型,某同学画出的MgO晶胞结构示意图如图所示,请改正图中错误:__________________________。
(3)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:
___________________________________________
___________________________________________。
(4)人工模拟酶是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当结合NNR′OHO或Cu(I)(I表示化合价为+1)时,分别形成a和b:
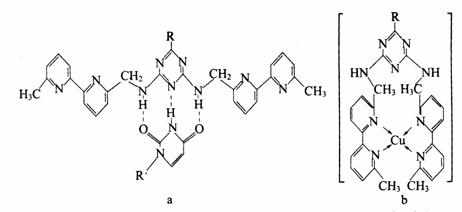
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有关晶体的叙述,错误的是( )
A.金刚石的空间立体网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
在1~18号元素中,部分连续元素单质的熔点情况如下图所示,试回答:
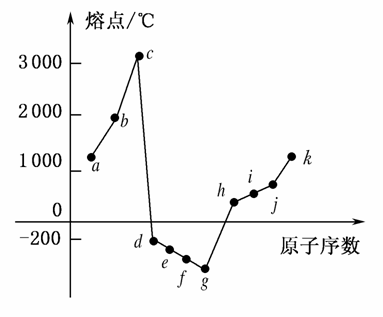
(1)c点代表的单质可以是________,其熔点高的主要原因是____________________________。
(2)d所属的晶体类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液由Na+、Cu2+、Ba2+、Fe3+、-、HCO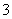 、SO
、SO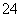 、Cl-中的若干种离子组成。取适量该溶液进行如下实验:
、Cl-中的若干种离子组成。取适量该溶液进行如下实验:
①向其中加入过量盐酸,有气体产生,并得到无色透明溶液;②向①所得溶液中加入过量氨水,产生白色沉淀,过滤;③向②所得溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;④向③所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述实验回答下列问题。
(1)原溶液中一定不存在的离子是__________;
(2)原溶液中一定存在的离子是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com