
下列关于物质分类的说法正确的是
A.醋酸、氨水、硫酸钡均属于弱电解质
B.铜合金、铝合金、钢铁均属于金属材料
C.动物油、植物油、矿物油均属于酯类化合物
D.稀豆浆、稀盐酸、硅胶均属于胶体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
检验氯化氢中是否含有氯气,可采用的方法是
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液中 D.将气体通入品红溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1mol二氧化硅晶体中含有4NA个硅氧键
B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA
C.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.将0.l mol FeC13滴入沸水中可制得0.1NA Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
向一定量的Cu、Fe2O3的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1 mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是
A.4.8 g B.8.8 g C.9.6g D.14.4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
用下列装置进行的实验中,能达到其实验目的的是.
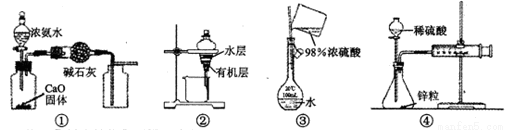
A.用装置①制取并收集干燥纯净的NH3
B.用装置②分离苯萃取碘水后已分层的有机层和水层
C.用装置③配制一定的物质的量浓度的稀硫酸
D.用装置④测定锌与稀硫酸反应的速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(12分)铝及其化合物用途广泛。工业上焙烧明矾【KAl(SO4)2·12H2O】可得到A12O3,反应的化学方程式为4KAl(SO4)2·12H2O+3S 2K2SO4+2A12O3+9SO2↑+48H2O。
2K2SO4+2A12O3+9SO2↑+48H2O。
请回答下列问题:
(1)在焙烧明矾的反应中,被氧化和被还原的元素质量之比是________________。
(2)焙烧明矾时产生的SO2可用来制硫酸。已知25℃、10lkPa时:
①2SO2(g) +O2(g)  2SO3(g) ΔH=—197KJ/mol
2SO3(g) ΔH=—197KJ/mol
②2H2O(g)  2H2O(l)ΔH=—44KJ/mol
2H2O(l)ΔH=—44KJ/mol
③2SO2(g) +O2(g) + 2H2O(g) 2H2SO4(l)ΔH=—545KJ/mol
2H2SO4(l)ΔH=—545KJ/mol
则反应SO3(g)+ H2O(l)= H2SO4(l)ΔH=______KJ/mol。
(3)工业上利用电解熔融的A12O3制备Al,其化学方程式是_____________________;电解时阳极和阴极材料均为石墨,电解时所消耗的电极是__________(填“阳极”或“阴极”)。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液,可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式为____________;②电池总反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
甲和乙两烧杯中各装有100mL 0.2mol/LAlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下列判断正确的是
A.实验过程中甲中和乙中的现象始终保持一致
B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的多
D.乙中沉淀可能比甲中的多
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
下列所陈述的事实与解释均正确的是
选项 | 事实 | 解释 |
A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
B | C2H5OH与浓硫酸共热170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期12月月考化学试卷(解析版) 题型:填空题
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3— + 4H+ + 3e- NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
NO↑+2H2O; KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式: 。
(2)反应中硝酸体现了 等化学性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com