
【题目】下列物质混合后,能产生蓝色沉淀的是( )
A.![]() 溶液与
溶液与![]() 溶液
溶液
B.![]() 溶液与
溶液与![]() 溶液
溶液
C.![]() 溶液与氨水
溶液与氨水
D.鸡蛋清与浓硝酸
【答案】B
【解析】
A. ![]() 溶液与
溶液与![]() 溶液反应生成氯化钠和氢氧化铁的红褐色沉淀,不能产生蓝色沉淀,A不符合题意;
溶液反应生成氯化钠和氢氧化铁的红褐色沉淀,不能产生蓝色沉淀,A不符合题意;
B. FeSO4溶液与K3[Fe(CN)6]溶液立即产生铁氰化亚铁的蓝色沉淀,即为滕氏蓝,2K3[Fe(CN)6]+3FeSO4=3K2SO4+Fe3[Fe(CN)6]2↓,B符合题意;
C. 刚滴入氨水,硝酸银过量,发生反应为:Ag++NH3·H2O=NH4++AgOH↓(白),2AgOH=H2O+Ag2O (灰黑);过量的氨水,沉淀溶解得到无色溶液,发生反应为:Ag2O+4NH3·H2O=2[Ag(NH3)2]OH+3H2O,不能产生蓝色沉淀,C不符合题意;
D. 将浓硝酸滴入鸡蛋清中,开始时会看见白色沉淀产生,是因为浓硝酸会使蛋白质变性,如果再微热一会的话,蛋白质就会变黄,形成“黄蛋白”,不能产生蓝色沉淀,D不符合题意;故答案为:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上60%的镁来自海水,从海水中提取镁工艺流程如图所示,下列说法正确的是( )
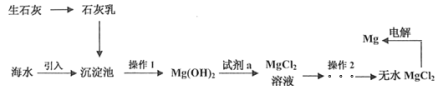
A.该工艺流程涉及的反应有分解反应、化合反应和置换反应
B.操作1为过滤,实验室里为加快过滤速度应用玻璃棒搅拌液体
C.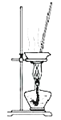 操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
D.该工艺的优点是原料来源广泛,同时获得重要的化工原料氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
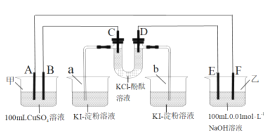
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学基本概念是学习化学的基石,请正确回答下列问题。
(1)今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。属于电解质的是___________,属于非电解质的是_____________。将①加入到⑦中,⑦的导电能力_______(填“增强”、“减弱”或“基本不变”)。
(2)漂白粉中加入盐酸,可产生氯气,化学方程式为:Ca(ClO)2+4HCl = CaCl2 +2Cl2+2H2O。用双线桥法表示该反应中电子转移的方向和数目_________,当有0.1 mol电子发生转移时,生成氯气的体积为_______L(标况下),被氧化的HCl为______mol。
(3)“四种基本反应类型与氧化还原反应的关系”如图所示:
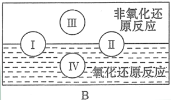
其中Ⅰ为化合反应,Ⅳ是_________反应。现有以下反应模型:单质A + 氧化物B=单质C + 氧化物D(A、B、C、D均为中学阶段常见物质,反应条件已略去),写出符合上述反应模型的化学反应方程式。
①若A为金属单质,B为非金属氧化物:_________________________。
②若A和C均为固体非金属单质:_______________________________。
(4)浓硫酸有强氧化性,常温下,向碳素钢(仅含铁、碳元素的合金)中加入少量浓硫酸,无明显现象,原因是:____________________,加热后,可能产生的气体有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成份如下图所示:
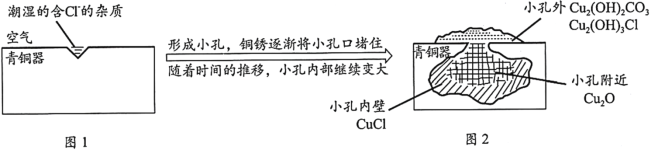
已知:2CuCl+H2O![]() Cu2O+2HCl
Cu2O+2HCl
下列分析不正确的是
A.氧气是正极反应物B.铜锈的成份与氧气浓度、pH有关
C.图2中,Cl-从小孔内向小孔外移动D.青铜中的锡也会发生电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com