
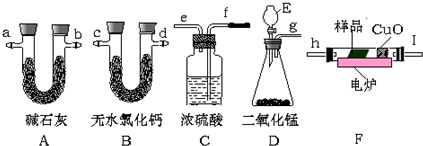
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入F中的氧气、D用来制取反应所需的氧气、F是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(1)根据产品的质量确定有机物的组成,测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,需要固体燃烧;
(2)由测定原理可知,A用来吸收二氧化碳,测定生成二氧化碳的质量,B是吸收生成的水蒸气测定质量;
(3)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成;
(4)H2O2在MnO2作催化剂的条件下分解生成氧气;
(5)CuO的作用是,使有机物充分氧化生成CO2和H2O,如果把CuO网去掉,燃烧不充分生成的CO不能被碱石灰吸收,导致二氧化碳的质量偏低;
(6)确定物质的化学式可借助元素的质量守恒进行解答;
(7)题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量;
(8)空气中二氧化碳、水影响有机物燃烧生成水、二氧化碳的质量,据此进行解答.
解答 解:(1)根据产品的质量确定有机物的组成,测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,需要固体燃烧,用该方法可测定含C、H或C、H、O元素的固态有机物,
故答案为:含C、H或C、H、O元素的固态有机物;
(2)由测定原理可知,A用来吸收二氧化碳,测定生成二氧化碳的质量,B中氯化钙是吸收生成的水蒸气测定质量,
故答案为:吸收燃烧后产生的水蒸气;
(3)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→F→B→A,所选用的各导管口连接的顺序是g接f,e接h,I接c或(d),d或(c)接a或(b),
故答案为:g接f,e接h,I接c或(d),d或(c)接a或(b);
(4)H2O2在MnO2作催化剂的条件下分解生成氧气,故E中盛放的是H2O2,故答案为:H2O2;
(5)CuO的作用是,使有机物充分氧化生成CO2和H2O,如果把CuO网去掉,燃烧不充分生成的CO不能被碱石灰吸收,导致二氧化碳的质量偏低,装置A的质量减小,故答案为:减小;
(6)A管质量增加1.76g为二氧化碳的质量,可得碳元素的质量:1.76g×$\frac{12}{44}$=0.48g,
B管质量增加0.36g是水的质量,可得氢元素的质量:0.36g×$\frac{2}{18}$=0.04g,
从而可推出含氧元素的质量为:1.8g-0.48-0.04=1.28g,
设最简式为CXHYOZ,则
X:Y:Z=$\frac{0.48}{12}$:$\frac{0.04}{1}$:$\frac{1.28}{16}$=1:1:2,即最简式为CHO2,
故答案为:CHO2;
(7)由上述(5)可知该有机物的最简式为CHO2,要确定有机物的分子式,还要知道有机物的相对分子质量,故答案为:B.
(8)由于装置内空气成分影响水、二氧化碳质量的测定,所以其目的是赶出装置内空气,减小实验误差,
故答案为:赶出装置内空气,减小实验误差.
点评 本题考查有机物组成的测定、物质性质实验方案的设计,题目难度中等,把握实验的原理和方法、明确实验操作目的是解答该题的关键,注意掌握质量守恒定律在确定有机物分子式中的应用,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 非金属元素形成的化合物不可能是离子化合物 | |
| B. | 金属原子和非金属原子间也可形成共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 共价化合物中不能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有A的单质存在同素异形体 | |
| B. | D的最高正价与B的最高正价相等 | |
| C. | A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C>B>A | |
| D. | 原子半径的大小顺序是C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | 反应通式配平为6NOx+4xNH3=(3+2x)N2+6xH2O | |
| C. | 当x=1时,每生成2.5mol N2,被氧化的气体有3mol | |
| D. | 当x=2时,有1mol气体被还原时,转移的电子为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com