
| A. | 若管道漏气遇氨会产生白烟 | B. | 该反应利用了氯气的强氧化性 | ||
| C. | 该反应属于复分解反应 | D. | 生成1 mol N2有6 mol电子转移 |
分析 反应3Cl2+2NH3═N2+6HCl中,Cl元素化合价降低,被还原,Cl2为氧化剂,N元素化合价升高,被氧化,NH3为还原剂,NH3与HCl反应生成氯化铵,有白烟生成,以此解答该题.
解答 解;A.反应生成HCl,可与氨气反应生成氯化铵,有白烟生成,故A正确;
B.反应3Cl2+2NH3═N2+6HCl中,Cl元素化合价降低,被还原,氯气体现氧化性,故B正确;
C.反应中Cl、N元素化合价发生变化,属于氧化还原反应,故C错误;
D.反应中N元素化合价由-3价升高到0价,则生成1 mol N2有6 mol电子转移,故D正确.
故选C.
点评 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
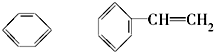
 )及一个氯原子,写出其结构简式并命名.
)及一个氯原子,写出其结构简式并命名.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
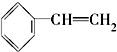 ④
④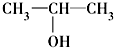 ⑤
⑤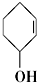 ⑥
⑥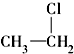 ⑦
⑦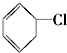 ⑧
⑧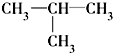 ⑨CH3-CH=CH2 (10)
⑨CH3-CH=CH2 (10)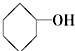 (11)
(11) ⑫CH3Cl
⑫CH3Cl
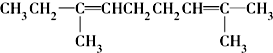 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 斜长石的氧化物形式可表示为:K2O•Al2O3•6SiO2 | |
| C. | 橄榄石中铁为+2价 | |
| D. | 月球上有游离态铁是因为月球上铁的活性比地球上铁的活动性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com