
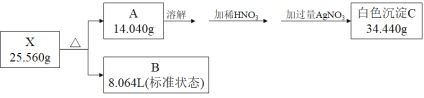
【题目】已知化合物X仅由三种短周期元素组成,X隔绝空气加热,可分解为盐A和气体B,有关该反应的物质转换、现象和量的关系如下图所示。
(1)检验盐A中阳离子的方法及现象是____________。
(2)请用双桥法分析并表达化合物X分解时,电子转移的方向和数目____________。
(3)白色沉淀C在紫外光照射下会发生分解,请写出该反应的化学方程式____________。
【答案】焰色反应,有黄色火焰 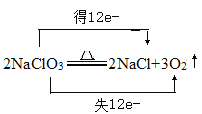 2AgCl=2Ag+Cl2↑
2AgCl=2Ag+Cl2↑
【解析】
气体B的物质的量是![]() ;根据质量守恒,B的质量是25.56g-14.04g=11.52g,气体B的相对分子质量是
;根据质量守恒,B的质量是25.56g-14.04g=11.52g,气体B的相对分子质量是![]() 32,所以B是氧气,氧原子的物质的量是0.72mol;A和硝酸银反应生成的白色沉淀C是AgCl,AgCl的物质的量是
32,所以B是氧气,氧原子的物质的量是0.72mol;A和硝酸银反应生成的白色沉淀C是AgCl,AgCl的物质的量是![]() ,即X中含有氯元素0.24mol,可知n(O): n(Cl)=3:1,所以X中含有
,即X中含有氯元素0.24mol,可知n(O): n(Cl)=3:1,所以X中含有![]() ,X中金属元素的质量为14.04g-0.24mol×35.5g/mol=5.52g;若金属元素为+1价,则金属元素的物质的量是0.24mol,相对原子质量是
,X中金属元素的质量为14.04g-0.24mol×35.5g/mol=5.52g;若金属元素为+1价,则金属元素的物质的量是0.24mol,相对原子质量是![]() ;若金属元素为+2价,则金属元素的物质的量是0.12mol,相对原子质量是
;若金属元素为+2价,则金属元素的物质的量是0.12mol,相对原子质量是![]() ,不可能是短周期元素,与题意不符;所以X是NaClO3;
,不可能是短周期元素,与题意不符;所以X是NaClO3;
(1)X是NaClO3,分解为NaCl和O2,A是NaCl,钠元素的焰色为黄色,用焰色反应检验钠离子。
(2)NaClO3分解为NaCl和O2,氯元素化合价由+5降低为-1,氧元素化合价由-2升高为0,NaClO3分解时,电子转移的方向和数目为 ;
;
(3)白色沉淀C是AgCl,在紫外光照射下会发生分解生成银和氯气,反应的化学方程式是2AgCl=2Ag+Cl2↑。


科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。
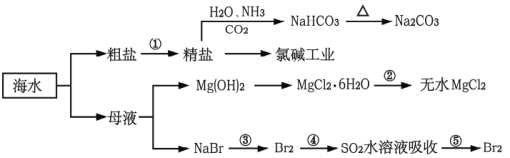
下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(1)硫原子的价层电子排布图为_____,烟花燃放过程中,钾元素中的电子跃迁的方式是____,K、S、N、O四种元素第一电离能由大到小的顺序为____。上述反应涉及的元素中电负性最大的是_____(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为______,CO2分子的立体构型为_____。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______。
③CO分子中π键与σ键个数比为______。
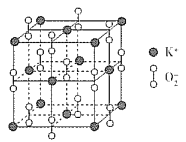
(3)超氧化钾的晶胞结构图如下,则与K+等距离且最近的O2 - 个数为_____,若晶胞参数为dpm,则该超氧化物的密度为___g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,100mL0.1mol·L-1 的H2A 溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
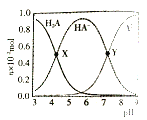
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.X 点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+) +c(Na+)=c(OH-)+3c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
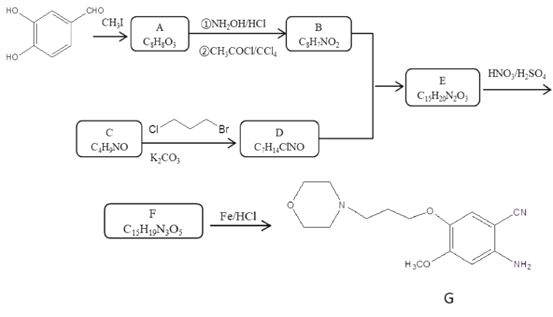
【题目】物质G是制备抗癌药物吉非替尼过程中重要的中间体,某研究小组按照下列线路合成中间体G。
已知: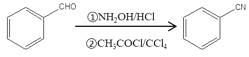 、
、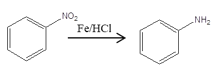 、
、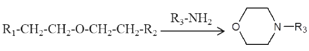 (同时还有H2O或卤化氢生成)
(同时还有H2O或卤化氢生成)
请回答:
(1)下列说法正确的是_______。
A.化合物A能够使酸性高锰酸钾溶液褪色
B.化合物A中含有4种不同的官能团
C.化合物C具有碱性
D.化合物G的分子式为C15H20N3O3
(2)上述路线中合成A的反应类型为______,化合物E的结构简式为______。
(3)写出C到D的化学反应方程式________。
(4)请设计以乙烯为原料转变为物质C的合成线路(用流程图表示,无机试剂任选)___。
(5)写出化合物B(C8H7NO2)可能的同分异构体_______。须同时满足:①能发生银镜反应;②1H—NMR谱显示分子中含有苯环,且分子中有4种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )

A. N4分子属于一种新型的化合物B. N4分子中只含有非极性键
C. 1 mol N4分子所含共价键数为4NAD. N4沸点比P4(白磷)高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃经O3氧化后,在锌存在水解可得到醛或酮,现有分子式为C7H14的某烯烃,它与氢气发生加成反应生成2,3-二甲基戊烷,被臭氧氧化后在锌存在下水解生成乙醛和一种酮(![]() ):
):
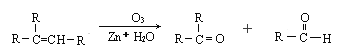
由此可推断该有机物的结构简式为( )
A. ![]() B.
B. 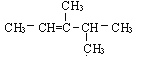
C. ![]() D. (CH3)2C=C(CH3)CH2CH3
D. (CH3)2C=C(CH3)CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com