
| A. | 增重30% | B. | 一定增加 | C. | 可能不变 | D. | 减轻30% |
分析 含铜绿Cu2(OH)2CO3的铜块,在空气中充分灼烧到质量不再变化为止,碱式碳酸铜分解,铜氧化,最终产物应为氧化铜;根据题意可知其中存在铜单质(部分变质),且有铜绿(有变质的部分).固体最多增重是由于Cu→CuO的变化,固体最多减轻是由于Cu2(OH)2CO3→CuO的变化,故可根据极值法求出增重最多的和减轻最少的进行判断.
解答 解:因为固体最多增重Cu→CuO,固体最多减轻Cu2(OH)2CO3→CuO,
①假设全部为铜:则加热变为氧化铜,会增重氧元素的质量,相当于铜元素质量的$\frac{16}{64}$×100%=25%;
②假设全部为铜绿:则加热后只余氧化铜,那么减轻的质量应为Cu2(OH)2CO3中保留CuO部分外的质量,
即$\frac{222-160}{222}$×100%=27.9%;
综上所属,由于是两种情况的混合物,所以固体质量的变化情况应是处于两者之间,也就是在增重25%与减轻27.9%之间的;当混合物中铜的含量约为52.8%时,反应前后固体质量不变即铜与氧气反应时得到的氧元素的质量等于碱式碳酸铜失去的水和二氧化碳的质量,所以固体质量可能不变,故C正确;
故选C.
点评 本题考查了运用质量守恒的规律,题目难度中等,通过归纳不同物质或不同变化过程中相同点和不同点,有效地寻找出它们之间的内在联系以及融合点和嫁接点,从而培养了学生的创新思维能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:| A. | 若x:y=1;2,则平衡时,M中的转化率:N2>H2 | |
| B. | 若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% | |
| C. | 若x=1,y=3,则达到平衡时反应物的转化率N>M | |
| D. | 平衡时N2气体在两容器中体积分数可能相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性 | |
| B. | 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性 | |
| C. | 乙醇与钠反应可以产生氢气,所以乙醇显酸性 | |
| D. | 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
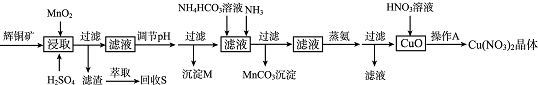
| 离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com