
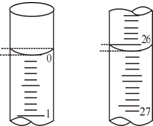
 为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂.请填写下列空白:
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测盐酸的体积/mL | 0.1000mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出 | ||||
| B、向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中 c(Ag+)=c(Cl-) | ||||
C、AgCl和Ag2CrO4共存的悬浊液中,
| ||||
| D、向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,11.2L氯气含有的分子数为0.5NA . |
| B、标准状况下,2.24L H2O 含有的分子数等于0.1NA . |
| C、1mol H2 与1mol Cl2 反应生成NA 个HCl |
| D、标准状况下,22.4LN2 和O2混合气体中所含有原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
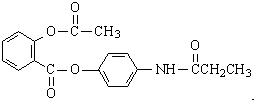 ,由它可衍生出一系列物质,有关变化如图:
,由它可衍生出一系列物质,有关变化如图: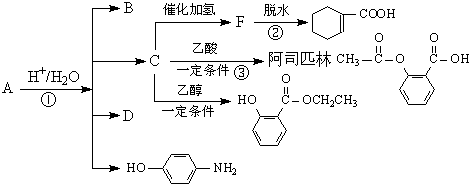
查看答案和解析>>
科目:高中化学 来源: 题型:
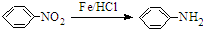 .请回答下列问题:
.请回答下列问题:
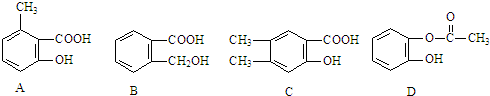
| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
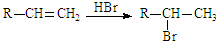 (主产物)
(主产物)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀盐酸 |
| B、AgNO3溶液 |
| C、FeCl3溶液 |
| D、Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积、等物质的量浓度的氨水与盐酸混合 |
| B、pH之和为14的氨水与硝酸等体积混合 |
| C、pH之和为14的Ba(OH)2溶液与NaHSO4溶液等体积混合 |
| D、等体积、等物质的量浓度的Ca(OH)2溶液与Na2CO3溶液混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com