
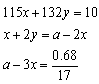
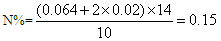 ��3�֣�
��3�֣�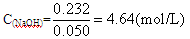 ��2�֣�
��2�֣�
 FeS
FeS 2Fe2O3��8SO2,
2Fe2O3��8SO2,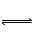 2SO3 ��V
2SO3 ��V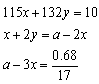
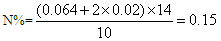 ��3�֣�
��3�֣�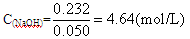 ��2�֣�
��2�֣�

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��SO2����Ӧ���Ʋ⣺�ǽ��������ﶼ����Ӧ |
| B���������Ż�����CO2�����Ʋ⣺�������Ż�Ҳ������CO2���� |
| C��Fe3O4�ɱ�ʾΪFeO��Fe2O3���Ʋ⣺Pb3O4Ҳ�ɱ�ʾΪPbO��Pb2O3 |
| D��F-Cl-Br-I�ĵ����۵��������ߣ��Ʋ⣺N-P-As-Sb-Bi�ĵ����۵�Ҳ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Fe2��SO4��3 | B��Na2CO3 | C��KNO3 | D��FeSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ҵ�����г�����ʯ�������շ����еĶ������� |
| B�����������ˮ��Һ��ʹ��ɫʯ����Һ��죬˵��������������ˮ��Ӧ������ |
| C������������ʹ��ɫ������ɫ��ʧ��˵������������������� |
| D������������ʹ���Ը��������Һ��ɫ��˵������������л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
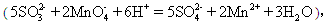 ����KMnO4��Һb mL��
����KMnO4��Һb mL���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڢݢ� | B���٢ܢ� | C���ۢܢ� | D���ܢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ɭ����ҿ��ķ����ƻ�����̬ƽ�� | B����ҵ�ϴ���ȼ�պ���ȼ�� |
| C�������ų�����β�� | D�������ж�����̼�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������AΪSO2��H2�Ļ���� | B������A��SO2��H2�������Ϊ4:1 |
| C����Ӧ�й�����Zn 97.5g | D����Ӧ�й�ת�Ƶ���3 mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com