
【题目】下列离子方程式中正确的是( )
A. 少量SO2通入NaOH溶液中:OH-+SO2=HSO3-
B. H2S通入氯水中:S2-+Cl2 =S↓+2Cl-
C. 二氧化氮溶于水:3NO2+H2O =2H++2NO3-+NO↑
D. 少量NaHSO4与过量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4KJ/mol
②C(s)+1/2O2(g)=CO(g) △H2=-110.45 KJ/mol,下列说法正确的是

A. C的燃烧热为110.45KJ/mol
B. 反应①若使用催化剂,△Hl会变小
C. 反应①中的能量变化如图所示
D. 反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的一组是( )
①不溶于水的BaSO4是强电解质 ②可溶于水的酸都是强电解质 ③0.5mol/L的所有一元酸中氢离子浓度都是0.5mol/L ④熔融态的电解质都能导电。
A. ①③④ B. ②③④ C. ①④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁和硫酸铝溶液等体积混合后,铝离子浓度为0.2mol/L,硫酸根离子的浓度为0.5 mol/L,则混和溶液中镁离子浓度为( )。
A. 0.15 mol/L B. 0.3 mol/L C. 0.45 mol/L D. 0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH = 14的溶液中,下列离子能大量共存的是
A. Na+、Al3+ 、NO3-、Cl- B. Na+、SO4 2-、Cl- 、NH4+
C. K+、Cl-、Na+、HCO3- D. S2-、NO3-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二价金属的碳酸盐和碳酸氢盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和碳酸氢盐的物质的量之比是( )
A. 1:1 B. 1:3 C. 1:2 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下: 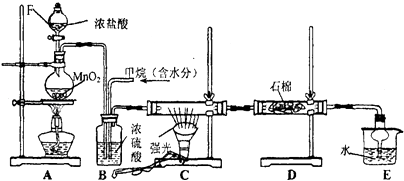
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②;③ .
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是 .
(3)D装置中的石棉上均匀附着KI粉末,其作用是 .
(4)E装置的作用是(填编号).
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 .
(6)装置E中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 , 该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,发生反应: 2NO2(g)![]() N2O4(g) △H=-24.4kJ/mol,每隔一段时间对该容器内的物质进行分析,得到数据如表所示:
N2O4(g) △H=-24.4kJ/mol,每隔一段时间对该容器内的物质进行分析,得到数据如表所示:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4 )/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)从反应开始至20s时,二氧化氮的平均反应速率为_______mol·L-1·s-1。
(2)n3=______,100℃时该反应的平衡常数为______(保留一位小数)。平衡后,若升高温度,该反应的化学平衡常数将_______(填“增大”、“减小”或“不变”)。
(3)下述各项能说明反应达到平衡状态的是_______(填序号)。
a.v正(N204)= 2v逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
(4)达到平衡后,分别在80s、120s、140s时只改变一个条件,v正、v逆发生如下图所示变化;则80s时改变的条件可能是________。

(5)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是_______mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com