
| A. | 5.4 g | B. | 8.4 g | C. | 4.1g | D. | 9.6g |
分析 三种金属中只有Al与氢氧化钠溶液反应,根据生成氢气的量可计算出混合物中含有铝的物质的量及质量;铜不与稀硫酸反应,混合物与稀硫酸反应生成的氢气是铝和Fe与反应生成的,根据电子守恒可知铝与硫酸反应生成的氢气体积为6.72L(标准状况),从而可计算出混合物中Fe的物质的量、质量,据此可计算出混合物中Cu的质量.
解答 解:将17.9gAl、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体6.72L(标准状况),氢气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,只有Al与NaOH溶液反应,则结合电子守恒可知混合物中Al的物质的量为:$\frac{0.3mol×2}{3}$=0.2mol,质量为:27g/mol×0.2mol=5.4g;
另取等质量的合金溶于过量的稀硫酸中,产生气体10.08L(标准状况),生成氢气的物质的量为:$\frac{10.08L}{22.4L/mol}$=0.45mol,Cu不与稀硫酸反应,则0.45mol氢气是Fe和Al与稀硫酸生成的,根据电子守恒可知Al与稀硫酸反应生成的氢气的物质的量为0.3mol,则Fe与稀硫酸反应生成氢气的物质的量为:0.45mol-0.3mol=0.15mol,结合电子守恒可知混合物中Fe的物质的量为:$\frac{0.15mol×2}{2}$=0.15mol,质量为:56g/mol×0.15mol=8.4g,
所以原混合物中含有Cu的质量为:17.9g-5.4g-8.4g=4.1g,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 容量瓶洗净后未干燥 | |
| B. | 移液后烧杯未洗涤 | |
| C. | 定容时俯视读数 | |
| D. | 摇匀后液面低于刻度线再滴加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
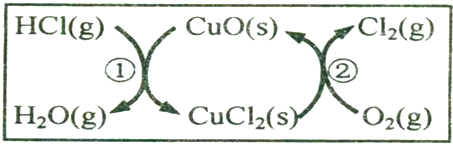
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 常温下,pH=3的盐酸稀释1000倍后pH=6 | 常温下,pH=6的盐酸稀释1 000倍后pH=9 |
| B | 电解熔融MgCl2可制取金属镁 | 电解熔融AlCl3也可制取金属铝 |
| C | Na着火不能用干冰灭火 | K着火也不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
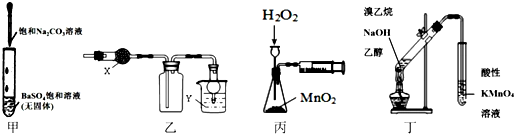
| A. | 甲可用于研究沉淀的转化,可比较出Ksp(BaSO4>Ksp(BaCO3) | |
| B. | 乙中X为无水CaCl2,Y为NaOH溶液时,该装置可用于SO2的收集 | |
| C. | 丙装置可定量测定H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a通入CO2,然后b通入NH3,c中放碱石灰 | |
| B. | a通入NH3,然后b入CO2,c中放蘸稀硫酸的脱脂棉 | |
| C. | b通入NH3,然后a通入CO2,c中放碱石灰 | |
| D. | b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论解释 | |
| A | 过量铁粉加稀硝酸充分反应,滴入KSCN溶液 | 产生红色溶液 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗一批作了银镜反应的试管,配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗实验. | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | 他们认为Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸酸性强于苯酚,溶液中还有Na2CO3生成 |
| D | 相饱和碳酸钠溶液通过量CO2气体 | 产生沉淀 | 因为析出Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com