
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |
分析 核磁共振氢谱中能出现两组峰,说明物质含有2种H原子,其峰面积之比为2:1,则两种H原子数目之比为2:1.
注意等效氢判断:①分子中同一甲基上连接的氢原子等效,②同一碳原子所连甲基上的氢原子等效,③处于镜面对称位置上的氢原子等效.
解答 解:A.乙酸甲酯(CH3COOCH3)中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为1:1,故A错误;
B.对苯二酚( )中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为2:1,故B正确;
)中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为2:1,故B正确;
C.2-甲基丙烷中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为9:1,故C错误;
D.对苯二甲酸(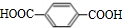 )中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为2:1,故D正确.
)中含有2种氢原子,核磁共振氢谱能出现两组峰,且其峰面积之比为2:1,故D正确.
故选:BD.
点评 本题考查有机物的结构,涉及核磁共振氢谱,关键是判断分子中H原子种类,注意等效氢判断方法,比较基础.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在三氯化铁的酸性溶液中通入足量的硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ | |
| B. | PbS与CuSO4溶液反应PbS+Cu2+═CuS+Pb2+ | |
| C. | Mg(HCO3)2与过量澄清石灰水反应 Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O | |
| D. | 铜银合金在稀硫酸溶液中构成原电池,正极反应式 2H+2e═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
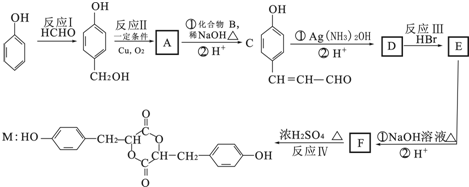
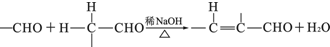
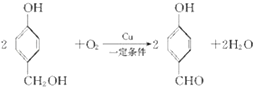 ;
;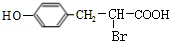 ;
;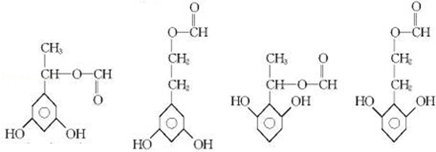 任意2种(任写两种).
任意2种(任写两种).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
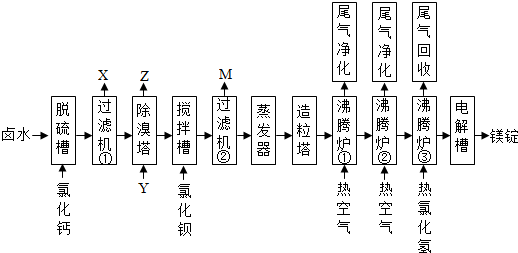
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
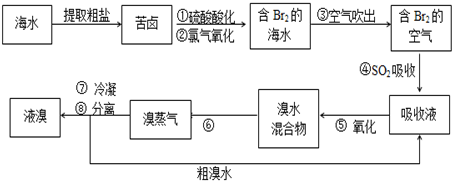
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
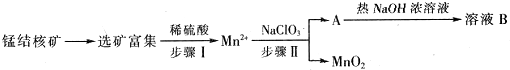
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的 c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com