
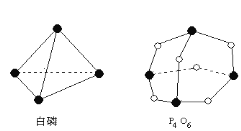
【题目】I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol1 ,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol1):P—P:198 P—O:360,则断开1molO2所需要的能量为 kJ
II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为 ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为 ,平衡常数为 。
【答案】Ⅰ498
Ⅱ(1)CO(g)+2H2(g)=CH3OH(g)△H=+258kJ·mol-1
(2)1/3(或33.3%);1L2·mol-2
【解析】
试题分析:设断开1molO2所需要的能量为xkJ,根据焓变=反应物的总键能-生成物的总键能,-1638 kJ=6×198+3x-12×360,x=498kJ;Ⅱ(1)根据盖斯定律,①+②-③得CO、H2化合制得1mol气态甲醇的热化学方程式为CO(g) +2H2(g)=CH3OH(g) △H=+258kJ·mol-1;(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,设参加反应的CO、H2的物质的量分别是xmol、ymol
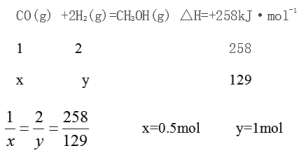
此时H2的转化率为![]() 33.3%,
33.3%,

平衡常数为![]() =1L2·mol-2。
=1L2·mol-2。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关。下列说法不正确的是( )
A. SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3
B. SO2具有还原性,可用于蔗糖脱色
C. 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D. 双氧水具有强氧化性,可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
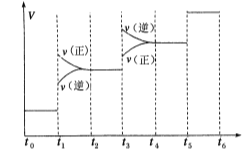
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A.离子化合物中一定存在离子键,可能存在共价键
B.由金属元素和非金属元素组的化学键一定是离子键
C.非极性键只存在于双原子单质分子中
D.NH4Cl是一种共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,已知下列反应均为放热反应,下列各热化学方程式中△H最小的是
A. 2A(l)+B(l) =2C(g) △H1 B. 2A(g)+B(g) =2C(g) △H2
C. 2A(g)+B(g) =2C(l) △H3 D. 2A(l)+B(l) =2C(l) △H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。

该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com