
| A、0.01mol/L |
| B、0.02mol/L |
| C、0.1 mol/L |
| D、0.2 mol/L |
科目:高中化学 来源: 题型:
| A、含有氧元素的化合物一定是氧化物 |
| B、在水溶液中能电离出H+的化合物一定是酸 |
| C、盐一定是有金属阳离子和酸根离子构成 |
| D、HCl不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al、NaCl |
| B、H2、Al(OH)3 |
| C、H2、NaCl、NaAlO2 |
| D、H2、NaCl、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、萃取操作时,所选萃取剂的密度没有特别限制 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、CO的燃烧热为283kJ |
B、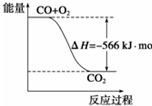 可表示有CO生成CO2的反应过程和能量关系 |
| C、Na2O2(s)+2CO2═Na2Co3(s)+O2(g)△H>-532kJ?mol-1 |
| D、CO(g)与Na2O2(s)反应放出549kJ热量时,电子转移数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ |
B、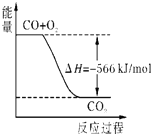 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com