
某温度下纯水的pH=6。
(1)pH=7的溶液呈__________(填“酸性”“中性”或“碱性”);
(2)该温度下0.1 mol·L-1的盐酸溶液的pH=__________;
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=__________。
科目:高中化学 来源: 题型:
典型元素及化合物的特征性质
(1)Na、Al、Fe、Cu四种元素的单质中:
①能与水剧烈反应的是____________,反应的离子方程式:
________________________________________________________________________;
②能与NaOH溶液反应的是________,反应的离子方程式:
________________________________________________________________________,
其中作氧化剂的是______________________________________________________________;
③Cu在潮湿的空气中被腐蚀的化学方程式:
________________________________________________________________________;
④与氧气反应条件不同,反应产物不同的是
________________________________________________________________________。
(2)上述四种金属的氧化物中:
①能用作供氧剂的是________,写出一个化学方程式:
________________________________________________________________________;
②既能溶于酸溶液又能溶于强碱溶液的是______________________________________,
离子方程式分别为__________________,______________________________________;
③常温下为黑色固体的是____________________________________________________。
(3)上述四种金属的氢氧化物中:
①易在空气中被氧化的是__________,现象_____________________________________,
反应的化学方程式为_________________________________________________________;
②具有两性的是___________________________________________________________。
(4)上述四种金属形成的阳离子共有________种,其中既能表现还原性,又能表现氧化性的是________,检验Fe2+的方法是__________________________________;其中氧化性最强的是________,它腐蚀金属铜的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
A.因为电离是吸热的,所以温度越高,同一弱电解质的电离平衡常数越小
B.弱电解质的电 离平衡常数只与弱电解质的本性及外界温度有关
离平衡常数只与弱电解质的本性及外界温度有关
C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱
D.多元弱酸的各级电离常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.pH<7的溶液不一定是酸溶液
B.常温下,pH=5的溶液和pH=3的溶液相比,前者[OH-]不一定是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使[NH4+]增大,则溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.05 mol NaOH固体分别加入到100 mL下列液体中,溶液的导电能力变化最小的是( )
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的打“√”,错误的打“×”
(1)所有的燃烧反应都是放热反应,所以不需要加热就能进行( )
(2)反应物的总能量低于生成物的总能量时,一定不能发生反应( )
(3)物理变化过程中,也可能有热量的变化( )
(4)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定( )
(5)一个反应的焓变因反应物的用量和反应条件的改变而发生改变( )
(6)催化剂能改变反应的焓变( )
(7)已知S(l)+O2(g)===SO2(g) ΔH=-293.23 kJ·mol-1,则S(s)+O2(g)===SO2(g)反应放出的热量大于293.23 kJ·mol-1( )
(8)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH不同( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2(g)2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则任何酸碱中和反应的热效应均为57.3 kJ
D.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应过程中能量的变化如图所示,图中E1表示正反应的活化能,E2表示逆反应的活化能,下列有关叙述正确的是
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.E1也可表示反应物断键需要吸收的总能量 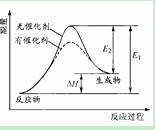
D.△H=E2-E1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com