
 工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水以及生活污水中浓度较高的NO3-会造成氮污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.

科目:高中化学 来源: 题型:
| A、不同条件下,1mol任何气体所含分子个数均相同 |
| B、1mol任何气体的体积均为22.4L |
| C、1mol气体在压强一定时,50℃时体积比20℃时体积大 |
| D、1LO2和1LO3在同温同压下具有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:


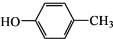 和CH3COOH为原料制备
和CH3COOH为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO
过二硫酸的化学式为H2S2O8,硫元素的形式氧化态可看作是+7,所以是一种强氧化剂.工业上常用电解硫酸和硫酸钾的混合溶液制过二硫酸钾,且在65℃时熔化并分解.电解反应的离子方程式是:2HSO- 4 |
| ||
2- 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
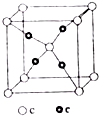 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、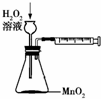 用以定量测定化学反应速率 |
B、 为用已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
C、 可以检查装置的气密性 |
D、 为实验室制取少量CO2的发生装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
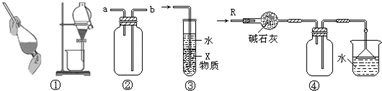
| A、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| B、装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C、装置①可用于分离乙醇和水的混合物 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com