
| A. | 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 氢氧燃料电池汽车的使用可以有效减少城市空气污染 | |
| D. | 燃料电池的能量转化率可达100% |
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | CO作还原剂 | ||
| C. | Fe2O3发生氧化反应 | D. | CO被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它的最高价氧化物的水化物是强酸 | D. | 它的位置在第7周期IVA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nmm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | L与T形成的化合物具有两性 | ||
| C. | L和Q金属性:Q<L | D. | 氢化物的稳定性为H2T<H2R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
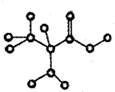 如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )
如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )| A. | 分子式为C3H7NO | |
| B. | 不能和NaHCO3溶液反应生成CO2 | |
| C. | 该分子中至少存在5个原子一定共面 | |
| D. | 可以与醇发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com