

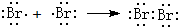 .
.  名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 | |
| D. | 某基态原子核外电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH<5的溶液中:NH4+、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- | |
| D. | 在滴加石蕊变蓝的溶液中:Na+、S2-、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
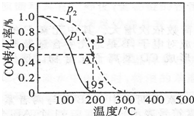 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
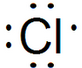 .
.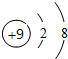 .
.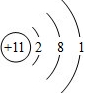 D2-的电子式为
D2-的电子式为 .
. ;Z元素原子的电子式为
;Z元素原子的电子式为 .
.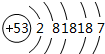 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
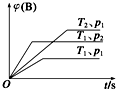 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H<0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
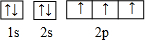 .
.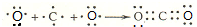 ,1molce2含有σ键的数目为6.02×1023.
,1molce2含有σ键的数目为6.02×1023.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com