
【题目】已知AJ 10种物质的转化关系如图所示:
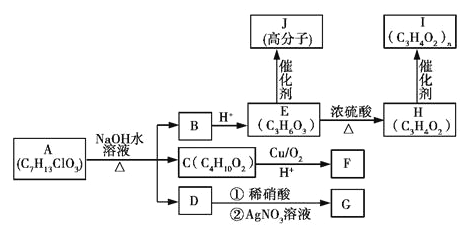
已知:①E分子中含有一个连有4个不同原子或原子团的碳原子。
②C分子中核磁共振氢谱中显示有四种不同的氢原子,且峰面积之比为4∶3∶2∶1。
③1 mol F与足量的新制氢氧化铜在加热条件下充分反应可生成2 mol砖红色沉淀。
④G为白色沉淀。
请回答下列问题:
(1)A中含有的含氧官能团的名称是______________。
(2)B的结构简式为__________________________。
(3)E生成H的化学方程式为_______________________________________。
(4)D的化学名称是__________________________________。
(5)高分子化合物J的结构简式为_______________________________。
(6)与C具有相同的官能团和相同的官能团数目,且官能团不在同一个碳原子上的C的同分异构体共有__________种,其中核磁共振氢谱有三种不同化学环境的氢原子,且峰面积之比为2∶2∶1的是________________________(写结构简式)。
【答案】 羟基、酯基 ![]()
![]()
![]() CH2—CHCOOH+H2O 氯化钠
CH2—CHCOOH+H2O 氯化钠 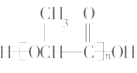
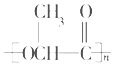 5 HOCH2CH2CH2CH2OH
5 HOCH2CH2CH2CH2OH
【解析】根据A的分子式和在NaOH溶液中反应生成B酸化后的E的分子式可知,E中含有羟基和羧基,根据A的分子式和在NaOH溶液中反应生成C的分子式可知,C为饱和二元醇,D能够与硝酸银溶液反应生成白色沉淀,可知D为NaCl,则A为含有Cl原子的酯,在NaOH溶液中发生卤代烃的水解和酯的水解,据E分子中含有一个连有4个不同原子或原子团的碳原子可知,E为CH3CHOHCOOH,B为CH3CHOHCOONa,据C分子中核磁共振氢谱中显示有四种不同的氢原子,且峰面积之比为4:3:2:1可知,C为HOCH2CH(CH3)CH2OH,则A为CH3CHClCOOCH2CH(CH3)CH2OH,E为CH3CHOHCOOH,能够通过酯化反应生成高分子化合物J,J为![]() ,E在浓硫酸作用下发生消去反应生成H,H为CH2=CHCOOH,H通过加聚反应生成I,I为
,E在浓硫酸作用下发生消去反应生成H,H为CH2=CHCOOH,H通过加聚反应生成I,I为![]() ,C为CH2OHCH(CH3)CH2OH,在Cu作催化剂时,催化氧化生成F,1mol F与足量的新制氢氧化铜在加热条件下充分反应可生成2mol红色沉淀,F为OHCCH(CH3)CHO;则
,C为CH2OHCH(CH3)CH2OH,在Cu作催化剂时,催化氧化生成F,1mol F与足量的新制氢氧化铜在加热条件下充分反应可生成2mol红色沉淀,F为OHCCH(CH3)CHO;则
(1)A为CH3CHClCOOCH2CH(CH3)CH2OH,其中含氧官能团有酯基、羟基;(2)据上述分析,B为CH3CHOHCOONa;(3)E为CH3CHOHCOOH,在浓硫酸作用下发生消去反应生成H,H为CH2=CHCOOH,反应方程式为:CH3CHOHCOOH![]() CH2=CHCOOH+H2O;(4)D能够与硝酸银溶液反应生成白色沉淀,可知D为NaCl;(5)E为CH3CHOHCOOH,能够通过酯化反应生成高分子化合物J,J为
CH2=CHCOOH+H2O;(4)D能够与硝酸银溶液反应生成白色沉淀,可知D为NaCl;(5)E为CH3CHOHCOOH,能够通过酯化反应生成高分子化合物J,J为![]() ;
;
(6)C为HOCH2CH(CH3)CH2OH,与C具有相同的官能团和相同的官能团数目,且官能团不在同一个碳原子上的C的同分异构体有:CH2OHCH2CH2CH2OH,CH2OHCHOHCH2CH3,CH2OHCH2CHOHCH3,CH3CHOHCHOHCH3,CH2OHC(CH3)OHCH3,共5种,其中核磁共振氢谱有三种不同化学环境的氢原子,且峰面积之比为2:2:1的是CH2OHCH2CH2CH2OH。


科目:高中化学 来源: 题型:
【题目】下列有关碱金属的说法不正确的是( )
A. 均为IA族元素,最外层均有1个电子
B. 单质的还原性:Li>Na>K>Rb>Cs
C. 碱性:LiOH<NaOH<KOH<RbOH<CsOH
D. 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.3 mol·L-1酒精溶液的密度为ρ1 g·mL-1,0.1 mol·L-1酒精溶液的密度为ρ2 g·mL-1,其中ρ1<ρ2,若将上述两溶液等质量混合,所得酒精溶液的物质的量浓度是( )
A. 大于0.2 mol·L-1 B. 等于0.2 mol·L-1
C. 小于0.2 mol·L-1 D. 无法估算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 能通过化合反应制得FeCl3和Fe(OH)3
B. 7.8gNa2O2与CO2完全反应,转移0.2mol电子
C. 2.7gAl与足量的氢氧化钠溶液完全反应,生成3.36L气体
D. NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O![]() 2H++2CrO42-(黄色),用K2Cr2O7溶液进行下列实验,结合实验下列说法不正确的是
2H++2CrO42-(黄色),用K2Cr2O7溶液进行下列实验,结合实验下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被乙醇还原
C. 对比②和④可知K2Cr2O7在酸性溶液中氧化性较强
D. 若向④中加滴加70%的硫酸溶液至过量溶液变橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道一些明胶企业将皮革废料熬制成工业明胶,出售给某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是________价。Cr![]() 是一种酸根离子,则Fe(CrO2)2属于________(填“酸”“碱”“盐”或“氧化物”)。
是一种酸根离子,则Fe(CrO2)2属于________(填“酸”“碱”“盐”或“氧化物”)。
(2)明胶的水溶液和K2SO4溶液共同具备的性质是________(填序号)。
a.都不稳定,密封放置产生沉淀 b.两者均有丁达尔效应 c.分散质微粒可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的________(填序号)。

(4)现有10 mL明胶的水溶液与5 mL Na2SO4溶液混合装入半透膜内,将此半透膜浸入盛蒸馏水的烧杯中,设计实验证明SO42-能够透过半透膜:________________________________
(5)绿矾对某工厂废水(含有强氧化性离子Cr2O7-)进行处理。
①工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:______________________。
②请配平方程式______________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com