
 铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:
铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B、沉淀溶解后,将生成深蓝色的配合离子[Cu(H2O)4]2+ |
| C、该实验能证明[Cu(NH3)4]2+比氢氧化铜稳定 |
| D、在[Cu(NH3)4]2+离子中,NH3给出孤电子对,Cu2+提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| c(Ba2+) |
| c(Mn2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
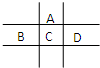 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠可用作供氧剂 |
| B、Cl2可与石灰乳反应制成漂白粉 |
| C、镁铝合金可用作制造飞机的材料 |
| D、用SO2漂泊食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸钡不溶于水,硫酸钡固体质量不会改变 |
| B、最终会得到BaSO4的极稀的饱和溶液 |
| C、Ba2++SO42-═BaSO4↓很容易发生,所以不存在BaSO4(s)?Ba2+(aq)+SO42-(aq)的反应 |
| D、因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com