
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.分析 (1)根据已知热化学方程式,利用盖斯定律计算和书写热化学方程式,2 I2(s)+5O2(g)=2 I2O5(s);△H=-75.56kJ•mol-1①,
2CO(g)+O2(g)=2 CO2(g);△H=-566.0kJ•mol-1②,
根据盖斯定律将方程式②×-①×$\frac{1}{2}$得;
(2)①化学平衡的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
③依据平衡常数概念写出该反应的平衡常数表达式,然后通过列式计算,依据浓度商和平衡常数比较分析判断;根据影响化学平衡的因素判断改变的条件.
解答 解:(1)由已知热化学方程式:
2 I2(s)+5O2(g)=2 I2O5(s);△H=-75.56kJ•mol-1①,
2CO(g)+O2(g)=2 CO2(g);△H=-566.0kJ•mol-1②,
根据盖斯定律将方程式②×-①×$\frac{1}{2}$得5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=(-566.0kJ•mol-1)×$\frac{5}{2}$-(-75.56kJ•mol-1)×$\frac{1}{2}$=-1377.22kJ/mol,
所以其热化学反应方程式为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol,
故答案为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol;
(2)①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,化学平衡的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
故答案为:$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,反应是气体体积减小的发热反应.
a.反应前后气体体积减小,体系压强都保持不变,能用于判断是否达到平衡状态,故a正确;
b.混合气体的一无颜色,颜色保持不变,不能说明达到平衡状态,故b错误;
c.生成物N2和CO2的体积比始终保持不变,不能说明达到平衡状态,故c错误;
d.每生成1mol N2的同时生成2mol NO,说明正逆反应速率相同,能判断是否达到平衡状态,故d正确;
故答案为:ad;
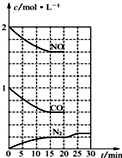
③依据图象可知,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该温度下该反应的平衡常数为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{0.{6}^{2}×1.{6}^{2}}$=0.035,
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则各组分浓度分别为:c(NO)=1.6mol/L、c(CO)=0.6mol/L+0.6mol/L=1.2mol/L、c(N2)=0.2mol/L+0.6mol/L=0.8mol/L、c(CO2)=0.4mol/L,Qc=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$=$\frac{0.8×0.{4}^{2}}{1.6×1.{2}^{2}}$=0.035=K,则化学平衡不动,20min时,若改变反应条件,导致N2浓度发生如图所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:不;b.
点评 本题考查了热化学方程式的书写方法,化学平衡的计算分析判断,原电池和电解池的原理的分析与计算,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑧ | B. | ②④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>c(Na+) | |
| D. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去MgCl2溶液中混有的少量FeCl3,可加入足量的Mg(OH)2粉末搅拌后过滤 | |
| B. | 在KI溶液中加人氯化银,一段时间后沉淀变成黄色,说明同温度下Kap(AgI)<Kap(AgCl) | |
| C. | 用强酸滴定强碱时,若选用甲基橙作指示剂,当达到滴定终点时溶液的颜色变化是由黄色变橙色 | |
| D. | 足量锌分别和等体积、等物质的量浓度的硝酸和醋酸反应时产生H2的量相等,放出H2的速率不等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO3→H2SO4→SO2 | B. | N2→NO→NO2→HNO3 | ||
| C. | Na→Na2O→NaOH→Na2CO3 | D. | Al→Al2O3→Al2(SO4)3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2A+B→2C+Q | B. | 2C→2A+B-Q | C. | 2A(g)+B(g)→2C(g)-Q | D. | 2A(g)+B(g)→2C(g)+Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com