
【题目】实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用___。当滴定至溶液由___时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为___mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2mol/L。在下述情况下,c1与c2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则c1___c2。
②当Na2CO3中含有NaOH时,则c1___c2。
【答案】甲基橙 橙色变为浅红色,且半分钟不恢复原色 ![]() mol/L > <
mol/L > <
【解析】
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,石蕊变色范围宽且颜色水易观察,不能用做中和滴定的指示剂、甲基橙变色范围是3.1-4.4可以指示反应终点、酚酞指示剂变色范围8-10,产生的误差较大,故三种指示剂中应选用甲基橙;当滴定至溶液由橙色变为浅红色,且半分钟不恢复原色时,即表示到达终点;
(2)若达到滴定终点时,
Na2CO3~~~2HCl
1 2
![]() V
V![]() 10-3L
10-3L![]() c
c
V![]() 10-3L
10-3L![]() c=2
c=2![]() ,解得c=
,解得c=![]() mol/L;
mol/L;
(3)①等质量的Na2CO3和NaHCO3与盐酸反应,后者消耗的盐酸少,当Na2CO3中含有NaHCO3时,造成待测测盐酸的体积偏小,即c1>c2;
②等质量的Na2CO3和NaOH与盐酸反应,后者消耗的盐酸多,当Na2CO3中含有NaOH时,造成待测测盐酸的体积偏大,即c1<c2。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A. 对2HI(g)![]() H2(g)+I2(g)平衡体系增大压强使气体颜色变深
H2(g)+I2(g)平衡体系增大压强使气体颜色变深
B. 向橙色 K2Cr2O7溶液中加入一定浓度的NaOH溶液后,溶液变为黄色
C. 红棕色的NO2,加压后颜色先变深后变浅
D. 溴水中有下列平衡Br2+H2O![]() HBr +HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr +HBrO,当加入AgNO3溶液后,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物中属于芳香烃的是________(填字母),它与苯的关系是________,写出苯与溴发生反应的化学方程式:__________________________。
预测该芳香烃________(填“能”或“不能”)发生该类反应。
![]()
②下列有机物中属于羧酸类的是________(填字母)。
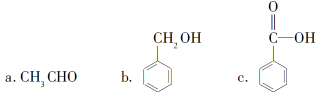
③下列有机物中属于糖类的是________(填字母)。
a.油脂 b.纤维素 c.蛋白质
(2)化合物X的结构简式为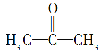 。
。
①一个X分子中有________种等效氢原子。
②X的一种同分异构体Z的结构简式为H2C===CH—CH2OH,请写出Z与Br2发生加成反应的化学方程式: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g)![]() B(g) ΔH>0,在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够长时间后反应再次达到平衡状态,此时c(A)/c(B=b,下列叙述正确的是( )
B(g) ΔH>0,在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够长时间后反应再次达到平衡状态,此时c(A)/c(B=b,下列叙述正确的是( )
A. 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
B. 若a=b,则容器中可能使用了催化剂
C. 若其他条件不变,升高温度,则a<b
D. 若保持温度、压强不变,充入惰性气体,则a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法正确的是( )
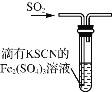
A.浓硫酸具有脱水性,可用于干燥氨气
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
D.如图装置中血红色褪去,可以验证 SO2 的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是( )
A. PH3和AsH3的熔点
B. Br2在水中的溶解度和Br2在CCl4溶液中的溶解度
C. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
D. HClO和HClO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑,下列推测正确的是( )

A. XeF2分子中各原子均达到8电子稳定结构
B. 某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF2
C. XeF4按已知方式水解,每生成3molO2,共转移12mol电子
D. XeF2加入水中,在水分子作用下将重新生成Xe和F2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为___,I和Cl相比,电负性较大的是___。
(2)碘原子价电子的电子排布图为___。
(3)I3+属于多卤素阳离子,推测 I3+的空间构型为___,中心I原子的杂化轨道类型为___。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___(填序号)。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有___个氯原子,RbICl2晶体的密度是___gcm-3(只要求列算式,不必计算出数值, 阿伏伽德罗常数为NA)。
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于 水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为____。
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___。
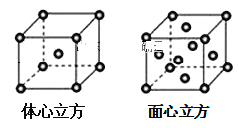
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是
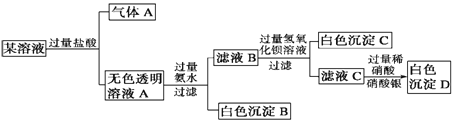
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com