


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④ |
| C、①③④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管用水洗后,未用标准溶液润洗就装入标准溶液 |
| B、锥形瓶盛待测液前,用待测液润洗 |
| C、读数时,滴定前仰视,滴定后俯视 |
| D、滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、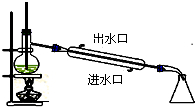 石油蒸馏 |
B、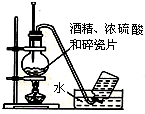 实验室用乙醇制取乙烯 |
C、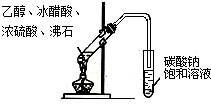 实验室制取乙酸乙酯 |
D、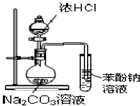 证明酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ |
| B、②③⑤④① |
| C、⑤①②③④ |
| D、⑤③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 平行实验编号 | Na2C2O4质量 (m g) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 1.34 | 0.00 | 25.02 |
| 2 | 1.34 | 0.02 | 25.00 |
| 3 | 1.34 | 0.18 | 25.18 |
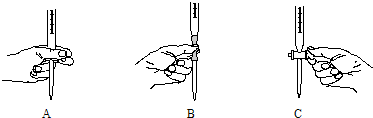
查看答案和解析>>
科目:高中化学 来源: 题型:
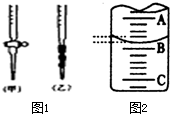 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
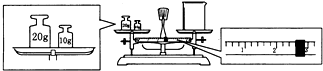 实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.
实验室欲用NaOH固体配制1.0mol?L-1的NaOH溶液240mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com