
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(2)依据①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ•mol-1,计算分析;
(3)依据热化学方程式③2C(s)+O2 (g)=2CO(g)△H=-221kJ•mol-1
④C(s)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1
结合盖斯定律计算得到所需的热化学方程式;
解答 解:(1)依据①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ•mol-1,可知氢气的燃烧热=$\frac{1}{2}$×-570kJ•mol-1=285KJ/mol,依据④C(s)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1,可知C的燃烧热为:393.5KJ/mol,
故答案为:285KJ/mol,393.5KJ/mol;
(2)依据①2H2(g)+O2 (g)=2H2O(l)△H=-570kJ•mol-1,4g氢气燃烧生成液态水放热570KJ,燃烧10gH2生成液态水,放出的热量为570KJ×$\frac{10}{4}$=1425KJ,
故答案为:1425KJ;
(3)③2C(s)+O2 (g)=2CO(g)△H=-221kJ•mol-1
④C(s)+O2 (g)=CO2(g)△H=-393.5kJ•mol-1
依据盖斯定律计算(④×2-③)×$\frac{1}{2}$得到,CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g);△H=-283KJ/mol;
点评 本题考查了热化学方程式书写方法,燃烧热概念实质理解应用,掌握盖斯定律的计算应用是解题关键,题目较简单.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ/mol | |
| B. | 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g)═2SO3(g)△H=-158.4kJ•mol-1 | |
| C. | NaOH(s)+$\frac{1}{2}$H2SO4(浓)═Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 0.1 | 0.3 | 0 | 4.63kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0)kJ |
| A. | 反应的平衡常数:①>② | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为2mol•L-1 | |
| C. | 达到平衡时,容器①、②中各物质的百分含量相同 | |
| D. | 若容器①体积为0.20L,则达平衡时放出的热量大于4.63kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

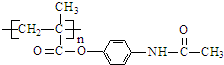 .
.

 与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
与1mol O2恰好可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
. ;扑热息痛的结构简式为
;扑热息痛的结构简式为 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com