
����Ŀ��������X���ȷֽ⣬�ɵ�A��B��D��E��F��ˮ���ֲ������A��B��D������ѧ��ѧ�г��������������E�ǵ���F����Ԫ�ص��⻯�
��1��A������ǿ�ᡢǿ�д��A��ǿ����Һ��Ӧ�����ӷ���ʽ ��
��2��B��D�������������������Ԫ����ͬ��D����ˮ��ǿ�ᣬ��B��D�����г���Ԫ����������һ��Ԫ�������ڱ��е�λ���� ��
��3��E��ʹʪ��ĺ�ɫʯ����ֽ������ʵ������ȡE����Ļ�ѧ����ʽΪ �� �Ƶõ����������ͼ��ʾװ���ռ���������Ӧ�����A����B����ͨ�룮
��4���ɸ��ֽ��������ʵ���֮���Ʋ�X��������������������仯ѧʽΪ �� ����X��Ũ��Һ�еμ�ŨNaOH��Һ����������������Ϊ���� ��
��5��ȡһ������X����ֽ⣬������F 1mol�����ͬʱ��������mol�� 
���𰸡�
��1��Al2O3+2OH��=2AlO2��+H2O
��2���������ڡ��� A��
��3��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��B
CaCl2+2NH3��+2H2O��B
��4��NH4Al��SO4��2?12H2O�����ɰ�ɫ���������ɴ̼�����ζ�����壻��ɫ�������ܽ�
��5��SO2��3
���������⣺��1����������ǿ����������ǿ��ij���������AΪAl2O3 �� ��ǿ����Һ��Ӧ�����ӷ���ʽΪ��Al2O3+2OH��=2AlO2��+H2O�� �ʴ�Ϊ��Al2O3+2OH��=2AlO2��+H2O����2����B��D�������������������Ԫ����ͬ��B��D�����г�����������һ��Ԫ�������ֻ������е����������ֱ�Ϊ50%��40%����֪B��D�ֱ�ΪSO3��SO2 �� ��Ԫ�������ڱ��е������ǵ������ڵڢ�A�壬
�ʴ�Ϊ���������ڡ���A�壻��3��E��ʹʪ��ĺ�ɫʯ����ֽ��������EΪNH3 �� ʵ�����Ʊ������ķ���ʽΪ��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O�����ڰ������ܶȱȿ���С��Ӧ�������ſ������ռ�����Ӧ��B��ͨ�������ռ���
CaCl2+2NH3��+2H2O�����ڰ������ܶȱȿ���С��Ӧ�������ſ������ռ�����Ӧ��B��ͨ�������ռ���
�ʴ�Ϊ��2NH4Cl+Ca��OH��2 ![]() CaCl2+2NH3��+2H2O��B����4���������Ϸ�����֪��X�к��������ӡ�笠����ӡ���������ӣ��ٽ��X�������������������֪�仯ѧʽΪ��NH4Al��SO4��212H2O��NH4Al��SO4��212H2O����Һ�к���笠����Ӻ������ӣ���������������Һ���������������������ӷ�Ӧ��������������ɫ�����������ӷ�Ӧ��ȫ��笠����������������ӷ�Ӧ���ɰ���������ɫ�����������������ܽ⣬
CaCl2+2NH3��+2H2O��B����4���������Ϸ�����֪��X�к��������ӡ�笠����ӡ���������ӣ��ٽ��X�������������������֪�仯ѧʽΪ��NH4Al��SO4��212H2O��NH4Al��SO4��212H2O����Һ�к���笠����Ӻ������ӣ���������������Һ���������������������ӷ�Ӧ��������������ɫ�����������ӷ�Ӧ��ȫ��笠����������������ӷ�Ӧ���ɰ���������ɫ�����������������ܽ⣬
�ʴ�Ϊ��NH4Al��SO4��212H2O�����ɰ�ɫ���������ɴ̼�����ζ�����壻��ɫ���������ܽ⣻��5������1molN2ת��6 mol���ӣ����ݵ����غ��غ㣬����SO2�����ʵ���Ϊ�� ![]() =3mol��
=3mol��
�ʴ�Ϊ��SO2��3��
��1����������ǿ����������ǿ��ij���������AΪAl2O3����2����B��D�������������������Ԫ����ͬ��B��D�����г�����������һ��Ԫ�������ֻ������е����������ֱ�Ϊ50%��40%����֪B��D�ֱ�ΪSO3��SO2����3��E��ʹʪ��ĺ�ɫʯ����ֽ��������EΪNH3�����ݰ������ܶȴ�Сѡ���ռ���������4��X�����������������������Ϸ���д������X�Ļ�ѧʽ��NH4Al��SO4��212H2O��Һ�к���笠����ӡ������ӣ���������������Һ�������ɰ�ɫ������Ȼ���������������ɫ�����ܽ⣬�ݴ˽��н�𣻣�5������1molN2ת��6 mol���ӣ����ݵ����غ��������SO2�����ʵ�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�ס������ֻ�����Ľṹ������������ȷ���ǣ� �� 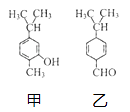
A.���һ�Ϊͬ���칹�壬�����ܷ���������Ӧ�����ܷ���������Ӧ
B.�����й�ƽ���̼ԭ������ͬ
C.���ú���������֣��������ú˴Ź�����������
D.��������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������Һ��
�� | �� | �� | �� | |
��Һ | pH=4��NH4Cl | pH=4������ | 0.1molL��1�Ĵ��� | 0.1molL��1��NaOH |
��֪���¶��´���ĵ���ƽϡ����Ka=1.8��10��5 �� ��ش��������⣺
��1���âܵı�Һ�ζ�����ѡ�����ʯ�������̪�����ȡ�����Ϊָʾ�����٢���Һ����ˮ�������c��H+��֮��Ϊ ��
��2�����ڢۢ�������Һ�ֱ��ˮϡ��10����pH�仯��С����������ű�ʾ������pH��ֽ�ⶨ��ҺpH�IJ��������� ��
��3������0.1mol/L�Ģ�NH4Cl����NH4HCO3����CH3COONH4����NH4HSO4����Һ��NH4+����Ũ�ȴ�С˳��Ϊ �� ���������д��
��4��ȡ������Һ�۵ζ�20mL��Һ�ܣ��ζ�������ͼ��ʾ����a��ʱ��Һ�и�����Ũ�ȵĴ�С��ϵΪ �� ��b��ʱ���Ģ۵����ΪV mL����V20�����������������=������ 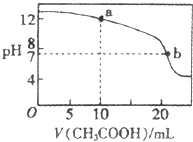
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO47H2O��������ȱ����ƶѪҩƷ����Ҫ�ɷ֣���������������м�����������������������ʣ�Ϊԭ�����������̷���һ�ַ����� 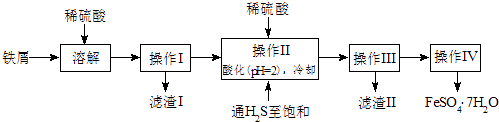
��֪�������±���H2S��Һ��pHԼΪ3.9��SnS������ȫʱ��Һ��pHΪ1.6��FeS��ʼ����ʱ��Һ��pHΪ3.0��������ȫʱ��pHΪ5.5��
��1������II�У�ͨ�����������͵�Ŀ����������Һ���������ữ��pH=2��Ŀ���� ��
��2������IV�õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ��ٳ�ȥ������渽�ŵ���������ʣ��� ��
��3���ⶨ�̷���Ʒ��Fe2+�����ķ����ǣ�a����ȡ2.8500g�̷���Ʒ���ܽ⣬��250mL����ƿ�ж��ݣ�b����ȡ25.00mL������Һ����ƿ�У�c���������ữ��0.01000mol/LKMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00mL�� �ٵζ�ʱ������Ӧ�����ӷ���ʽΪ�� ��
�ڵζ�ʱʢ��KMnO4��Һ������Ϊ�����������ƣ����жϴ˵ζ�ʵ��ﵽ�յ�ķ�����
�ۼ���������Ʒ��FeSO47H2O����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��Cl2�������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ij��ȤС��ͨ��ͼ1װ�ã��г�װ���ԣ������Ʊ������ա��ͷź�Ӧ�ý������о��� 
��1������D�������� �� ��װF�е���ʱ��Ӧѡ��ͼ2�е� ��
��2����B�Ļ�����A�з�����Ӧ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��ΪʹClO2��D�б��ȶ���������գ��μ�ϡ������ٶ�������족����������
��3���ر�B�Ļ�����ClO2��D�б��ȶ�����ȫ��������NaClO2 �� ��ʱF����Һ����ɫ���䣬��װ��C�������� ��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� �÷�Ӧ�����ӷ���ʽΪ �� ��ClO2�ͷ�ʵ���У���E�Ļ�����D�з�����Ӧ����װ��F�������� ��
��5��������ClO2������ȶ�������ȶ���������ͷ�ClO2��Ũ����ʱ��ı仯��ͼ3��ʾ������������ˮ�����ʣ�����ΪЧ���Ϻõ��ȶ����� �� ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu3N�ľ����ṹ��ͼ��N3������λ��Ϊ �� Cu+�뾶Ϊacm��N3���뾶Ϊbcm��Cu3N���ܶ�Ϊgcm��3 �� �� ����٤��������NA��ʾ��Cu��N��Է�������Ϊ64��14�� 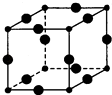
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ���������ж��֣�����ɱ������ǿ�Ҳ���Ӱ��ˮ�ʵ�������������(����)
A.����
B.Ư��
C.Һ��
D.��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com