
 (并标出电子转移的数目和方向).
(并标出电子转移的数目和方向).分析 (1)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高;
(2)鉴别NaNO2和NaCl,利用2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝分析;
(3)NaNO2直接排放会造成污染,需要具有还原性的物质将其氧化生成氮气;
(4)根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应,则离子大量共存.
解答 解:(1)2NaNO2+4HI═2NO+I2+2NaI+2H2O中,N元素的化合价降低,I元素的化合价升高,则NaNO2为氧化剂,有0.75mol的还原剂被氧化,则被还原的氧化剂有0.75mol,
故答案为:NaNO2;0.75;
(2)鉴别NaNO2和NaCl,由2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝可知,则选择试剂为②⑤,
故答案为:②⑤;
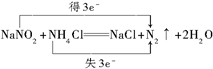
(3)NaNO2直接排放会造成污染,需要具有还原性的物质将其氧化生成氮气,则选择氯化铵即可,发生NaNO2+NH4Cl═NaCl+N2↑+2H2O,其余选项不符合,电子转移的方向和数目为 ,
,
故答案为:②; ;
;
(4)A.NH4+、OH-结合生成弱电解质,不能共存,故A错误;
B.Fe2+、NO3-、H+发生氧化还原反应,不能共存,故B错误;
C.CH3COO-、H+结合生成弱电解质,不能共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故答案为:D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、转移电子、配平及分析能力的考查,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氢原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| C. | 2.3g金属钠变为钠离子失去电子数为0.05NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | 分别由${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti组成的金属钛单质是混合物 | |
| C. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti互为同素异形体 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti原子的核外电子排布相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | Na2CO3 | C. | 氯水 | D. | NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高正化合价为+2 | B. | 该元素原子核外共有5个电子层 | ||
| C. | 该元素原子的M能层共有8个电子 | D. | 该元素原子最外层共有3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | 金刚石的熔点低于石墨 | 金刚石是原子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | Y的氢化物的水溶液可用于雕刻玻璃 | |
| C. | X、Y、Z、M的单质分别与水反应,Y最剧烈 | |
| D. | R的最高价氧化物的水化物能与其气态氢化物反应生成盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com