
 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
分析 (1)根据滴定管的精确度为0.01mL;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算,V(标准)用2次的平均值;在NaOH溶液中酚酞为红色,滴定终点时未无色;
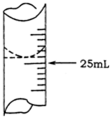
解答 解:(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.90ml,滴定管中的液面读数为24.90ml-1.100ml=23.80mL,
故答案为:23.80;
(2)标准液消耗的体积V(标准)=$\frac{20.10+21.40-1.50}{2}$mL=20.00ml;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=$\frac{0.1000×0.020}{0.025}$mol/L=0.0800mol•L-1;滴定终点时,滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色,即为滴定终点,
故答案为:0.0800;滴入最后一滴盐酸,溶液有红色变为无色,且半分钟不恢复红色.
点评 本题考查了的使用、滴定计算、达到终点判断、中和滴定中的误差分析,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图,从下表中选出| 锥形瓶中的液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| ① | 碱 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 碱 | 酚酞 | (甲) |
| ③ | 碱 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 碱 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤1为吸热反应,步骤2为放热反应 | |
| B. | E2>E3>E1 | |
| C. | 1mol C发生该反应时吸收的能量为E3-E1 | |
| D. | E2-E1<E2-E3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:9 | B. | 10:9 | C. | 9:2 | D. | 9:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com