
【题目】工业上制备纯硅反应的热化学方程式:SiCl4(g)+2H2(g)===Si(s)+4HCl(g) ΔH=+Q kJ·mol-1(Q>0)。某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是
A. 当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
B. 反应过程中,若增大压强能提高SiCl4的转化率
C. 若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
D. 反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
【答案】A
【解析】
根据化学反应速率的定义、计算公式分析;根据外界条件对化学平衡移动的影响分析。
由方程式可知,当反应吸收热量为0.025QkJ时,生成HCl的物质的量为:0.025QkJ/QKJ·mol-1×4=0.1mol,100mL1mol/L的NaOH的物质的量为:0.1L×1mol/L=0.1mol,二者物质的量相等,恰好反应,故A正确;
从方程式可以看出,反应物气体的计量数之和小于生成物气体的计量数之和,则增大压强,平衡向逆反应方向移动,SiCl4的转化率减小,故B错误;
该反应为可逆反应,具一定的限度,故1molSiCl4不能完全转化,达到平衡时,吸收热量一定小于QkJ,故C错误;
反应至4min时,若HCl浓度为0.12mol/L,则v(HCl)= 0.12mol/L÷4min =0.03mol/(Lmin),根据反应速率之比等于化学计量数之比,则v(H2)= ![]() ×v(HCl)=
×v(HCl)=![]() ×0.03mol/(Lmin)=0.015mol/(Lmin),故D错误。
×0.03mol/(Lmin)=0.015mol/(Lmin),故D错误。
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;与过量氯气发生S2Cl2+Cl2 温度超300℃以上完全分解为硫和氯气 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式为_________________________________________________________。
(3)C、D中的试剂分别是_________________、_____________________。
(4)仪器A、B的名称分别是___________、___________,F的作用是_______________________。
(5)如果在加热E时温度过高,对实验结果的影响_________________________________;在F中可能出现的现象是________________________________________________。
(6)S2Cl2粗品中可能混有的杂质是(填写两种物质的化学式)______________、_____________,为了提高S2Cl2的纯度,关键的操作是控制好温度和_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐酸的密度为![]() ,HCl的质量分数为
,HCl的质量分数为![]() ,试计算:
,试计算:
(1)该盐酸的物质的量浓度是多少?(小数点后保留两位)_________
(2)在足量的该盐酸溶液中,加入镁粉和铝粉混合物![]() ,充分反应共生成
,充分反应共生成![]() 气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
气体(标准状况),求混合物中镁和铝的质量各为多少?____________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH一,下列说法正确的是

A. Li极有机电解质可以换成Cu极的水溶液电解质
B. 放电时,正极的电极反应式为:Cu2O+2H++2e-=2Cu+H2O
C. 放电时,Cu极的水溶液电解质的PH值减小
D. 通空气时,整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)t℃时,Kw=___,最初混合酸中c(SO42-)=___,c(Cl-)=____。
(2)A点pH=_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是
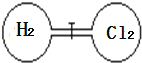
A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①标准状况下,1体积水中最多能溶解500体积的HCl;②饱和NaCl溶液的浓度约为5.00mol·L-1。
(1)在标准状况下,将448LHCl气体溶于1 L水中,所得溶液A的密度为1.20 g·cm-3,则溶液A中HCl的物质的量浓度为____。(本题计算结果均取三位有效数字)
(2)若使1L饱和氯化钠溶液中Cl-浓度与溶液A中的Cl-浓度相等,则在1LNaCl饱和溶液中还应溶解约___L标准状况下HCl气体(溶液体积变化忽略不计,不考虑氯化钠析出)。
(3)若将10.0mL溶液A稀释成500mL溶液B,则溶液B中HCl的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com