
下列叙述中,不正确的是( )
|
| A. | 某特定反应的平衡常数仅是温度的函数 |
|
| B. | 催化剂不能改变平衡常数的大小 |
|
| C. | 平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
|
| D. | 化学平衡发生移动,平衡常数必发生变化 |
| 化学平衡常数的含义.. | |
| 专题: | 化学平衡专题. |
| 分析: | A、特定反应的平衡常数只随温度变化; B、催化剂只改变反应速率不改变化学平衡; C、平衡常数改变,反应温度一定改变;化学平衡发生移动; D、改变浓度、压强平衡也会发生移动,但平衡常数不变; |
| 解答: | 解:A、特定反应的平衡常数只随温度变化;故A正确; B、催化剂只改变反应速率不改变化学平衡;催化剂不能改变平衡常数的大小,故B正确; C、平衡常数改变,反应温度一定改变;化学平衡一定发生移动;故C正确; D、改变浓度、压强平衡也会发生移动,但平衡常数不变;,故D错误; 故选D. |
| 点评: | 本题考查了化学平衡常数的计算,含义理解,影响因素的分析判断,化学平衡常数时温度的函数,题目较简单. |


科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠和水的反应:Na + H2O = Na+ + OH- + H2↑
B.氯化铝溶液中加入过量氨水:Al3+ + 3NH3?H2O = Al(OH)3↓+ 3NH4+
C.铁粉加入稀硫酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑
D.氢氧化钡溶液跟稀硫酸反应:Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 |
|
| B. | 一般认为沉淀离子浓度小于1.0×10﹣5 mol/L时,沉淀就达完全 |
|
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) |
|
| D. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是工业生产中的重要化工原料,也是高中化学非常重要的化合物,高考的热点内容.
(1)请写出实验室制取NH3的化学方程式 Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(2)为了快速得到大量的NH3,可通过浓氨水和固体氧化钙作用获得,分析其中的原因 氨水中存在NH3+H2O⇌NH3.H2O⇌NH4++OH﹣氧化钙溶水产生大量OH﹣,使平衡逆向进行有利于NH3放出.同时氧化钙溶水放出大量热,使气体溶解度下降,有利于NH3放出.
多余 (用离子方程式和简要的文字说明)
(3)用排空气法收集到的氨气是相同条件下氢气密度的10.5倍,用此氨气做喷泉实验,液体上升到容器容积的  ,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
,若外界条件为标准状况,所得氨水的物质的量浓度为 0.045mol/L .
(4)科学家利用氨气在纯氧中燃烧,可生成N2和水的原理.设计成NH3﹣O2燃料电池,碱性条件下该电池负极电极反应为: 2NH3+6OH﹣﹣6e﹣=N2+6H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的下列叙述,正确的是( )
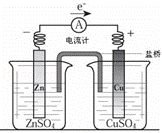
|
| A. | 电流方向是从锌片经导线流向铜片 |
|
| B. | 锌是阳极,锌片上有大量气泡产生 |
|
| C. | 铜离子在铜片表面被氧化,质量逐渐增大 |
|
| D. | 盐桥作用主要是离子通道和保持溶液电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应叙述相符合的是( )
|
| A. | 图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
|
| B. | 图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
|
| C. | 图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
|
| D. | 图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl﹣的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快.
(1)写出该反应的离子方程式 .
(2)反应开始时反应速率加快的原因是 .
(3)反应后期反应速率减慢的原因是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
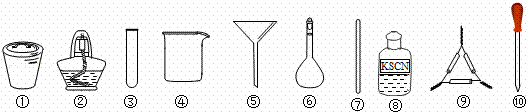
|
| A. | 将茶叶灼烧灰化,选用①、②和⑨ |
|
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
|
| C. | 过滤得到的滤液,选用④、⑤和⑦ |
|
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com