
| A. | 平衡时SO2的转化率:A>B | |
| B. | 可逆反应从开始到平衡放出的热量:A<B | |
| C. | 平衡时混合气体的总物质的量:A<B | |
| D. | 平衡时的化学反应速率:A>B |
分析 起始时向这两个容器中分别充入SO2和O2各l g,反应向气体的物质的量减小的方向移动,A容器能保持恒容,B容器有一个可以移动的活塞能使容器内保持恒压,则B的压强大于A的压强,压强越大,反应速率越大,从压强对平衡移动的影响分析.
解答 解:A.B中压强增大,平衡向生成SO3的方向移动,B容器中SO2的转化率大,A<B,故A错误;
B.B中压强增大,平衡向生成SO3的方向移动,B容器中SO3的体积分数大,从开始到平衡放出的热量:A<B,故B正确;
C.B中压强增大,平衡向生成SO3的方向移动,则达到平衡时A容器中气体的物质的量更多,平衡时混合气体的总物质的量:A>B,故C错误;
D.起始时向这两个容器中分别充入SO2和O2各l g,反应向气体的物质的量减小的方向移动,A容器能保持恒容,B容器有一个可以移动的活塞能使容器内保持恒压,则A的压强小于B的压强,压强越大,反应速率越大,则B达到平衡,反应速率:A<B,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,注意计较两容器的不同状态,从压强对平衡移动的影响角度分析.


科目:高中化学 来源: 题型:多选题
| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g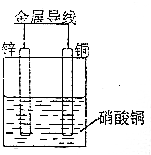 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
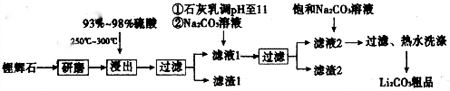
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
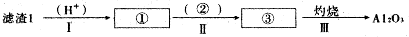
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
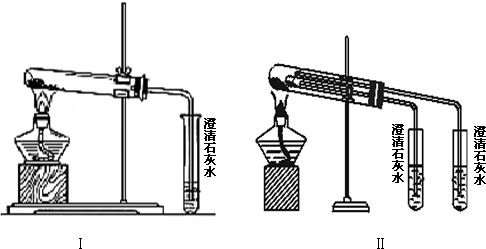
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H+?H2CO3 | B. | HCO3-+OH-═H2O+CO32- | ||
| C. | NH3+H+═NH4+ | D. | NH3•H2O?NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
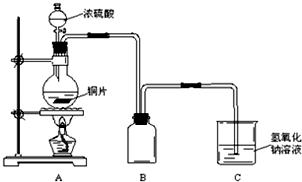
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④ | C. | ①③④⑤ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com