
��KMnO4��һ�ֳ��õ�ǿ����������ҵ�Ͽ��������̿���Ҫ�ɷ�MnO2��Ϊԭ�ϣ�ͨ��
Һ�෨���������ڼ�������������������MnO2�õ�K2MnO4�������õ�K2MnO4����
�������������������������K2MnO4��Һ�õ�KMnO4��������������������ʾ��
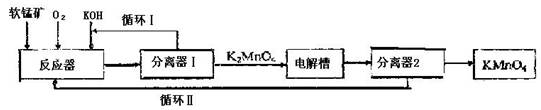
�ش��������⣺
��1��д����Ӧ���з�Ӧ�ķ���ʽ
��2���������������ʹ�ú�MnO280%���ϵĸ�����ΪMnO2������͵�ƶ����Al��
Si�������ﺬ���ϸߣ��ᵼ��KOH������ƫ�ߣ��÷���ʽ��ʾKOH����ƫ�ߵ�ԭ��
�� ��
��3��д�������������������ĵ缫��Ӧ����ʽ
������ �������� ��
�ڵ�ⷨ��ѭ���������õĹ�ͬ������ ��
��4���ڴ�ͳ�����У��õ�K2MnO4��������ͨ��CO2�Ʊ�KMnO4����ƽ����ʽ
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
����������Ӧ����MnԪ�صĽǶȿ���KMnO4�IJ������Ϊ ����ô�ͳ��
����ȣ���ⷨ�������� �� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
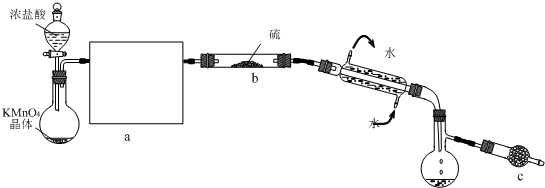

| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

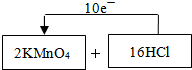

| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ�鷽�� | ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com