
【题目】在一恒容密闭容器中发生某化学反应2A(g)B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B,C的起始浓度都为0,反应物A的浓度(molL﹣1)随时间(min)的变化如图所示,请回答: 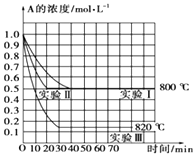
(1)在实验Ⅰ中,反应在0至40min内A的平均反应速率为molL﹣1min﹣1 .
(2)实验Ⅱ和实验Ⅰ的比较,可能隐含的反应条件是
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应升高温度,平衡向(填“正”或“逆”)反应方向移动,该正反应是(填“放热”或“吸热”)反应.
【答案】
(1)0.0125
(2)实验Ⅱ使用了催化剂
(3)逆;吸热
【解析】解:(1)实验Ⅰ中,反应在0min至40min内A的浓度变化为1mol/L﹣0.5mol/L=0.5mol/L,所以v(A)= ![]() =0.0125 molL﹣1min﹣1 , 所以答案是:0.0125molL﹣1min﹣1;(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂,所以答案是:实验Ⅱ使用了催化剂;(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
=0.0125 molL﹣1min﹣1 , 所以答案是:0.0125molL﹣1min﹣1;(2)实验Ⅱ和实验I相比,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂,所以答案是:实验Ⅱ使用了催化剂;(3)实验Ⅲ和实验Ⅰ的比较,降低温度,平衡时A的浓度增大,平衡向逆反应移动,降低温度平衡向放热反应移动,故正反应为吸热反应.
所以答案是:逆;吸热.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】拟用下图所示装置制取并收集下表中的四种气体(图中夹持仪器均已略去;a、b、c表示相应仪器中加入的试剂)能达到实验目的的是( )
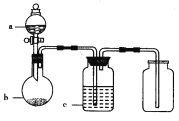
选项 | 气体 | a | b | c |
A | H2 | 稀硫酸 | 锌 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 |
C | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
D | NO | 稀硝酸 | 铜 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
A.已知A?+H2B(过量) ![]() HA+HB? , 则结合H+的能力:HB?<A?<B2?
HA+HB? , 则结合H+的能力:HB?<A?<B2?
B.在0.1 mol?L?1的氨水中滴加0.1 mol?L?1盐酸,恰好完全中和时溶液的pH=a , 则由水电离产生的c(OH?)=10?a mol?L?1
C.将c mol?L?1的醋酸溶液与0.02 mol?L?1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka= ![]()
D.将0.2 mol·L?1盐酸与0.1 mol·L?1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:
c(Cl?)>c(K+)>c(Al3+)>c(H+)>c(OH?)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当在空气中容易变质。
(1)某过氧化钠样品已经部分变质,只限用一种溶液,请你设计一种简便的化学方法,证明过氧化钠已经变质。____________________________________________
(2)若用最简单的实验来检验样品中还有过氧化钠,除试管、胶头滴管等外还需用的实验用品有:____________________________________________
(3)某课外活动小组为了测定样品,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。(假设C中Na2O2完全反应)。实验过程记录如下: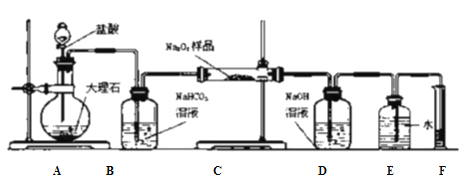
a.检查装置气密性;b.往玻璃管中放入a g样品,其它仪器中均加入足量的相应试剂,从分液漏斗往烧瓶中加入过量盐酸,立即发生剧烈反应,将广口瓶中的水排入量简中;c实验结束后,测量量筒中收集到的水的体积,进行计算。
①写出装置A和B中发生反应的离子方程式:
装置A:__________________________________;
装置B:____________________________________。
②他们在读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和NH3H2O反应的中和热△H=2×(﹣57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+2×283.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于“用CCl4萃取碘的饱和水溶液中的碘”的实验,下列说法正确的是( )
A. 使用的实验仪器是容量瓶和烧杯
B. 静置后所得液体上层呈紫红色
C. 碘在CCl4中的溶解度比在水中的溶解度小
D. 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: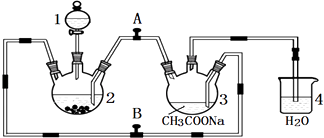
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 . A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.48g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两个实验:(N2O42NO2△H>0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com