
| A. | 铝热剂的反应原理是利用铝的强还原剂 | |
| B. | 铝热剂的反应常用于冶炼难熔金属 | |
| C. | 铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以是一个吸热反应 | |
| D. | 铝和所有金属物都可以组成铝热剂 |
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸的装运包装箱应贴上如图所示标志  | |
| B. | 少量金属金属钠保存在CCl4中 | |
| C. | 镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 | |
| D. | 用25ml酸式滴定管量取20.00ml0.01 mol/L的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液中加氨水:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤与实验现象 | 实验结论 |
| Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是Cu2+、MnO4-、Fe2+ |
| Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是Mg2+、Ag+、Ba2+、Al3+、I-、SiO32-,一定含有的离子是CO32-、K+ |
| Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是AlO2-,生成沉淀A的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
| Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有BaCO3,可能含有BaSO4 |
 (3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2→MnO4- | B. | A1O2-→Al(OH)3 | C. | AsO33-→AsO43- | D. | MnO2→MnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
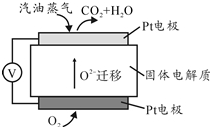 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O${\;}_{2}^{-}$查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 18 g H2O含有10NA个质子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol•L-1NaCl溶液中Na+数目为0.5 NA | |
| B. | 2 g氢气中含有的原子数为NA | |
| C. | 3.01×1023个氮气分子中含有的原子数为2NA | |
| D. | 在标准状况下2.24 L氨气(NH3)所含分子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com