
| A. | 对硝基苯酚的结构简式: | B. | 甲烷的比例模型: | ||
| C. | 甲基的电子式: | D. | 葡萄糖的实验式:CH2O |
分析 A.硝基书写不规范,硝基正确表示应该为:O2N-;
B.甲烷为正四面体结构,C原子的相对体积大于H原子;
C.甲基中含有3个碳氢键,碳原子最外层为7个电子;
D.实验式是用元素符号表示化合物分子中元素的种类和各元素原子个数的最简整数比的式子,结合葡萄糖的分子式书写判断.
解答 解:A.对硝基苯酚中N原子与苯环C相连,则对硝基甲苯正确的结构简式为: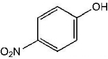 ,故A错误;
,故A错误;
B.甲烷中C的相对体积大于H原子,其比例模型为: ,故B正确;
,故B正确;
C.甲基中碳原子最外层为7个电子,甲基的电子式为 ,故C正确;
,故C正确;
D.葡萄糖的分子式为C6H12O6,其实验式为CH2O,故D正确;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、比例模型、结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油加水作护肤剂 | |
| B. | 蜂、蚁蛰咬处涂抹稀氨水可解痛 | |
| C. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 | |
| D. | 医用酒精可用于皮肤的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:X<X- | |
| B. | 简单氢化物的稳定性:Z比W的强 | |
| C. | W的氧化物的水化物的酸性一定比Z的强 | |
| D. | 最外层电子数由大到小的顺序为:Z、W、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若再加入X,平衡向正反应方向移动,Z在平衡混合物中的体积分数一定增大 | |
| B. | X的正反应速率是Y的逆反应速率的m/n倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 通入稀有气体使压强增大,平衡将向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com