
下列现象或应用不能用胶体的知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
科目:高中化学 来源: 题型:
在常温下,下列五种溶液:①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4
③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液
⑤0.1 mol·L-1 NH3·H2O。
请根据要求填写下列空白:
(1)溶液①呈________性(填“酸”、“碱”或“中”),其原因是________________________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是________;c(NH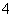 )最小的是________(填序号)。
)最小的是________(填序号)。
(3)比较溶液②、③中c(NH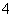 )的大小关系是②________③(填“>”“<”或“=”)。
)的大小关系是②________③(填“>”“<”或“=”)。
(4)在溶液④中,__________的浓度为0.1 mol·L-1;NH3·H2O和__________的物质的量浓度之和为0.2 mol·L-1。
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”“<”或“=”)NH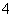 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH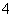 浓度的大小关系是:c(CH3COO-)________c(NH
浓度的大小关系是:c(CH3COO-)________c(NH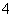 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列有关叙述正确的是( )
A.在0 ℃时,22.4 L氢气中含有2NA个氢原子
B.电解食盐水若产生2 g氢气,则转移的电子数目为NA
C.1 mol乙烷分子中共价键总数为7NA
D.密闭容器中46 g NO2含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+)=2 mol·L-1,c(SO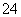 )=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+ 分离,至少应加入1.6 mol·L-1的苛性钠溶液( )
)=6.5 mol·L-1,若将200 mL此混合液中的Mg2+和Al3+ 分离,至少应加入1.6 mol·L-1的苛性钠溶液( )
A.0.5 L B.1.625 L
C.1.8 L D.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液的叙述中正确的是
A. NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-)
B. 0.1 mol/L 的醋酸钠溶液20 mL与0.1 mol/L盐酸10mL 混合后溶液显酸性:
c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:
c(Na+)=c(SO42-) >c ( NH4+)> c(H+)>c(OH-)
D. 向1.00L 0.3 mol/L NaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:
c(Na+)>c(CO32-) >c(HCO3-)>c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
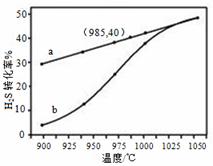 利用H2S废气制取氢气来的方法有多种
利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+ 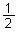 S2(g)
S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K=___ ___;说明随温度的升高,曲线b向曲线a逼近的原因:
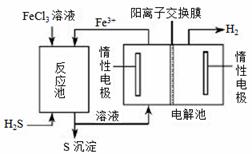 ②电化学法
②电化学法
该法制氢过程的示意图如右。反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。反应后的溶液进入电解池,电解总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01 mol的酸性混合溶液中加入0.01 mol铁粉,经搅拌后发生的变化应是 ( )
A.铁溶解,析出0.01 mol Ag和0.005 mol Cu
B.铁溶解,析出0.01 mol Ag并放出H2
C.铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+
D.铁溶解,析出0.01 mol Ag,溶液中不再有Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com