
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式??????????????????????? ,第二步的电离平衡常数表达式Ka2=?????????????? 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是???????????? 。
①I-???????????? ②Fe3+????????????? ③Cu2+??????????? ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式:?????????????????? 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:
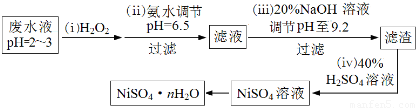
①第(ⅰ)步,加入H2O2反应的离子方程式?????????????????? 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是???????????????? 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为?????????????? 。
(1)H2O2 H+ + HO2-(2分)???
H+ + HO2-(2分)??? 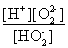 或
或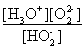 (3分)
(3分)
(2)①④(2分)
(3)O2 + H2O + 2e- = HO2-+ OH- (3分)
(4)①2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O(3分)
②尿糖的检测(2分)
③NiSO4·6H2O (3分)
【解析】
试题分析:(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2 H+ + HO2-;第二步电离为:HO2-
H+ + HO2-;第二步电离为:HO2- O22?+H+,所以电离平衡常数Ka2=
O22?+H+,所以电离平衡常数Ka2=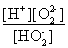 。
。
(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I?、Fe2+具有较强的还原性,故①④正确。
(3)正极为O2得电子,根据总反应方程式,O2中O元素化合价降低转化为HO2-,则正极反应方程式为:O2 + H2O + 2e- = HO2-+ OH-
(4)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O
②第(ⅱ)步,滤渣中的主要成分为Cu(OH)2,在医疗上可用于尿糖的检测。
③根据方程式:Ni2++ H2Y2-=NiY2-+ 2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O
考点:本题考查电离方程式与电极方程式的书写、物质的用途、电离平衡常数、化学式的推断。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省大庆实验中学高三(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com