
用符号“<”、“>”、“=”连接下列各项关系.
(1)金属性:Mg________Cs、Ge________Sn;
(2)非金属:N________As、F________S;
(3)酸性: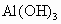 ________
________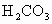 、
、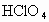 _________
_________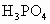 ;
;
(4)与水反应的剧烈程度Ca_________Mg、Be_________K;
(5)主族序数__________原子最外层电子数_________元素最高正化合价数.
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
 2SO3 的两个素材:
2SO3 的两个素材:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com