
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,2.24L SO3含有的分子数为0.1NA
B.常温下,3.0g甲醛含有C-H键数目为0.2NA
C.含有2molH2SO4的浓硫酸与足量Cu加热条件充分反应,电子转移数是2NA
D.1L 1mol/L AlCl3溶液含Al3+数目为NA
科目:高中化学 来源:2014-2015学年湖南省高三上学期第三次月考化学试卷(解析版) 题型:填空题
(8分)活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:

一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
pH | 3.2 | 6.7 | 8.0 | 9.7 |
(1)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入__________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(2)杂质Cu2+可利用置换反应除去,应选择的试剂是____________________________。
(3)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:填空题
(选考)【选修3:物质结构与性质】(10分)
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为 (用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 ,B元素与D元素形成分子空间构型为 ;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是______________________________________;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,
观察到的现象为 ;
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为_______,C晶体的密度为 g·cm-3(要求写表达式,可以不化简)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.大理石溶于醋酸:CaCO3+2H+ = Ca2++CO2↑+H2O
B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+ = 2Fe3++2Cl-
C.向澄清石灰水中通入少量CO2:OH-+CO2 = HCO3-
D.酸性氢氧燃料电池的正极反应:H2-2e- = 2H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:推断题
(选考)【化学——有机化学基础】(15分)
有机物A是常用的食用油抗氧化剂,分子为C10H12O5,可发生如下变化:
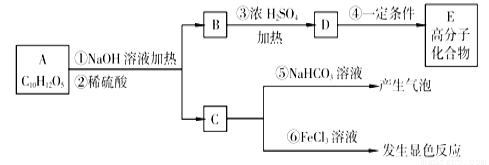
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为: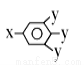 (其中-x、-y均为官能团)。请回答下列问题:
(其中-x、-y均为官能团)。请回答下列问题:
(1)根据系统命名法B的名称为 。
(2)官能团-x的名称为 ,高聚物E的链节为 。
(3)A的结构简式为 。
(4)反应⑤的化学方程式为 。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式 、 。
①含有苯环 ②能发生银镜反应 ③含有酚羟基
(6)从分子结构上看,A具有抗氧化作用的主要原因是 (填序号)。
A.含有苯环 B.含有羰基 C.含有酚羟基
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三上学期期末理综化学试卷(解析版) 题型:选择题
分类是化学学习和研究中的常有用手段,下列分类依据和验论都正确的是
A.浓HC1、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸
B.Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属电解质
C.NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物
D.金刚石、二氧化硅、碳化硅晶体中的原子均能以共价键结合,都属原子晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
下列说法正确的是
A.该反应的△H> 0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5 ×103 kPa和250℃的条件,其原因是原料气的转化率高
D.t℃时,向1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:推断题
(7分)暗紫色化合物A可作为电极材料的新型超铁电磁,因具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)3.96 g化合物A中含有Fe元素的物质的量为 mol,含有钾元素的物质的量为 mol。化合物A的化学式为 ;
(2)化合物A与H2O反应的离子方程式为 。
(3)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:填空题
(14分)I.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

(1)上图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_________________________________________。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题。
①试比较K1、K2的大小,K1___________K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是______________(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得NH3和N2、H2的物质的量分别为1mol和2mol、3mol时,则该反应的v(N2)正______________v(N2)逆(填写“>”、“=”或“<”)。
II.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)。
酸或碱 | 电离平衡常数(Ka或 Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
请回答下列问题:
(1)上述四种酸中,酸性最弱的是_________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是_________________(填序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈____(选填“酸性”“中性”或“碱性”),理由是:__________________________,溶液中各离子浓度大小的关系是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com