
| 选项 | 实验操作 | 实验目的 |
| A | 将C2H4和SO2的混合气体通入足量酸性KmnO4试液中 | 得到纯净的C2H4 |
| B | 向5mL 0.1mol•L-1AgNO3溶液中加1mL0.1mol•L-1NH3•H2O | 制备银氨溶液 |
| C | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 | 制备纯净的FeCl2溶液 |
| D | 向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤 | 制备NaHCO3固体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.C2H4为乙烯,能够被酸性高锰酸钾溶液氧化;
B.配制银氨溶液时,加入的氨水应该过量;
C.亚铁离子的还原性大于溴离子,加入氯水后亚铁离子被氧化,无法得到纯净的氯化亚铁溶液;
D.氨气的溶解度较大,制备碳酸氢钠时先通入氨气再通入二氧化碳.
解答 解:A.将C2H4和SO2的混合气体通入足量酸性KmnO4试液中,二者都被氧化,无法得到纯净的C2H4,故A错误;
B.向5mL 0.1mol•L-1AgNO3溶液中加1mL0.1mol•L-1NH3•H2O,加入氨水较少,得到的为氢氧化银沉淀,应该加入过量氨水之至沉淀溶解,故B错误;
C.向含少量FeBr2的FeCl2溶液中滴入适量新制氯水后,亚铁离子优先反应,无法获得纯净的FeCl2溶液,故C错误;
D. 由于二氧化碳的溶解度较小、氨气的溶解度较大,则制备NaHCO3固体的方法为:向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质分离与提纯、侯氏制碱法原理、银氨溶液制备等知识,明确常见化学实验基本操作方法即可解答,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
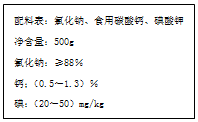 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
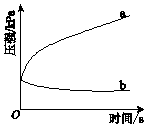 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 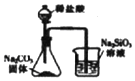 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 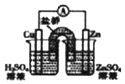 如装置能组成Cu-Zn原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 向试管中加2mL溶液 | 实验现象 |
 | 实验I:0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验II:2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
| 实验III:pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色固体 |
| 实验 | 操作 | 现象 |
| 实验IV | 向装有相同镁条的试管中加入2mL1.0mol/L (NH4)2SO4溶液 | 产生气体的速率明显慢于实验II |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
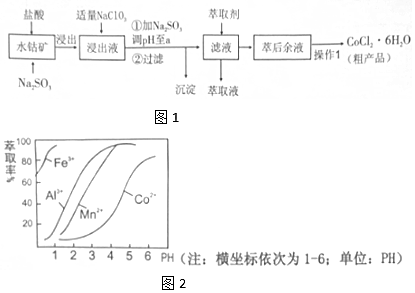
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代染坊常用某种“碱剂”来促进丝绸表层的丝胶蛋白杂质水解而除去,该“碱剂”,的主要成分是一种盐.这种“碱剂”可能是草木灰 | |
| B. | 生活中常用的塑料制品、橡胶制品为离分子材料,钢化玻璃、有机玻璃是硅酸盐材料 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 聚乙炔经处理后可形成一种导电塑料,该塑料是一种纯净物,有固定的熔点、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH:①>③>② | |
| B. | 水电离出的(H+):③>②>① | |
| C. | ①和②等体积混合后的溶液:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | ①和③等体积混合后的溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O=Ca(OH)2 | B. | 2Na2O2+2H2O=4NaOH+O2↑ | ||
| C. | 2Na+2H2O=2NaOH+H2↑ | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com