

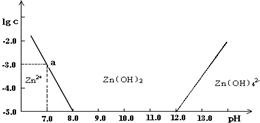
(1)��ZnCl2��Һ�м�������������������Һ����Ӧ�����ӷ���ʽ�ɱ�ʾΪ____________��
(2)��ͼ�����ݼ���ɵ�Zn(OH)2���ܶȻ�(Ksp)=___________��
(3)ij��Һ�к�Zn2+���ӣ�Ϊ��ȡZn2+���ӿ��Կ�����Һ��pH�ķ�Χ��____________��
(4)��
(5)��֪����ZnCl2��Һ�м�������Ǧ�����Ǧ��Һ�����Ƶ�PbCl2��ɫ���壻
c(HCl)/mol��L-1 | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/mol��L-1��10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
�����ϱ������ж�����˵����ȷ����___________(����ĸ���)��
A.��������Ũ�ȵ�����PbCl2������ܽ���ȱ�С���ֱ��
B.PbCl2������0.50 mol��L��1�����е��ܽ��С���ڴ�ˮ�е��ܽ��
C.PbCl2����Ũ���ᷴӦ����һ���ѵ����������(���������)
D.PbCl2��������ڱ���ʳ��ˮ
(1)Zn2++4OH-![]() ��Zn(OH)4��2��
��Zn(OH)4��2��
(2)10-17
(3)(8.0��12.0)
(4)1.80
(5)ABCD
������(1)NaOH����ʱ��Zn2+���ɣ�Zn(OH)4��2-����Ӧ�����ӷ���ʽΪZn2++4OH-![]() ��Zn(OH)4��2-��
��Zn(OH)4��2-��
(2)��ͼ���֪��Zn(OH)2���ܶȻ�Ksp=10-3��(10-7)2=10-17��
(4)c(Zn2+)��(10-8)2=10-17
c(Zn2+)=0.10 mol��L-1
Zn2+ + 2OH-![]() Zn(OH)2��
Zn(OH)2��
0.90 mol 1.80 mol
(5)�ݱ������ݷ�����A��B��C��D����ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
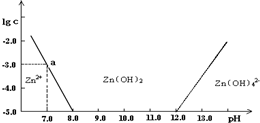 �����¶���п��ˮ��Һ�еĴ�����ʽ��pH�Ĺ�ϵ��ͼ��������Ϊ��Һ��pH��������ΪZn2+ ��Zn��OH��42-�������ӣ����ʵ���Ũ�ȵĶ���������Zn2+����Ũ��Ϊ10-5mol?L-1ʱ��Zn2+�����ѳ�����ȫ��������˵����ȷ���ǣ�������
�����¶���п��ˮ��Һ�еĴ�����ʽ��pH�Ĺ�ϵ��ͼ��������Ϊ��Һ��pH��������ΪZn2+ ��Zn��OH��42-�������ӣ����ʵ���Ũ�ȵĶ���������Zn2+����Ũ��Ϊ10-5mol?L-1ʱ��Zn2+�����ѳ�����ȫ��������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���㽭ʡ���������ѧУ�߶��꼶��ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ѡ����
��֪п���仯����������������仯�������ơ���ͼ��������Ϊ��Һ��pH��������ΪZn2�����ӻ�[Zn(OH)4]2�����ӵ����ʵ���Ũ��(����Zn2������Ũ��Ϊ10��5mol��L��1ʱ��Zn2�������ѳ�����ȫ)������˵������ȷ����
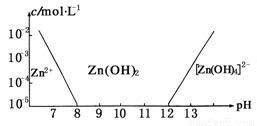
A����ZnCl2��Һ�м�������������������Һ����Ӧ�����ӷ���ʽ�ɱ�ʾΪ��
Zn2����4OH����[Zn(OH)4]2��
B����ͼ�����ݼ���ɵ�Zn(OH)2���ܶȻ�Ksp��10��17
C��ij��Һ�к�Zn2�����ӣ�����Zn2�����ӿ��Կ�����ҺpH�ķ�Χ��8��12
D����1 L 1 mol��L��1ZnCl2��Һ�м���NaOH������pH��6����NaOH 0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ͼ�����ݼ���ɵ�Zn��OH��2���ܶȻ�Ksp=10-17 |
| B��pH��12����Һ�в�����Zn��OH��42- |
| C��ij��Һ�к�Zn2+���ӣ�����Zn2+���ӿ��Կ�����ҺpH�ķ�Χ��8��12 |
| D����1L 1mol?L-1ZnC12��Һ�м���NaOH������pH=7����NaOH 2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��11�֣���ͼ��������Ϊ��Һ��pHֵ��������ΪZn2+ ���ӻ�Zn(OH)42-���ӣ������ӣ����ʵ���Ũ�ȵĶ������ش��������⡣

��1����ZnCl2��Һ�м�������������������Һ����Ӧ�����ӷ���ʽ�ɱ�ʾΪ
�� ������������������
��2����ͼ��a�����ݼ���ɵ�Zn(OH)2���ܶȻ�K spֵΪ ���� ��
��3��ij��Һ�к�Zn2+ ���ӣ�Ϊ��ȡZn2+���ӿ��Կ�����Һ��pHֵ�ķ�Χ�� ��
��4����1L 1.00 mol/L ZnCl2��Һ�м���NaOH������pH=6�����ݣ�2������õ�K spֵ�����ͼ���еĹ�ϵ���������NaOH mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com