
【题目】常温下,下列溶液中的粒子浓度关系正确的是
A. NH4Cl溶液中:c(Cl)=c(NH4+)>c(OH)=c(H+)
B. Na2SO4溶液中:c(Na+)+c(H+)=c(SO42)+c(OH)
C. NaHCO3溶液中:c(Na+)>c(HCO3)>c(CO32)>c(OH)
D. 浓度均为0.lmol/L的CH3COOH与CH3COONa溶液等体积混合后,pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9) mol/L
【答案】D
【解析】
A.NH4Cl溶液中,NH4+会发生水解反应:NH4++H2O![]() NH3H2O+H+,NH4+水解消耗,c(Cl)>c(NH4+),当最终达到平衡时溶液中c(H+)>c(OH),溶液显酸性,所以A错误;
NH3H2O+H+,NH4+水解消耗,c(Cl)>c(NH4+),当最终达到平衡时溶液中c(H+)>c(OH),溶液显酸性,所以A错误;
B.根据电荷守恒可得:c(Na+)+c(H+)=2c(SO42)+c(OH),B错误;
C. NaHCO3溶液中:HCO3-会发生水解反应而消耗,HCO3-++H2O![]() H2CO3+OH-,所以c(Na+)>c(HCO3);HCO3-发生电离作用产生c(CO32),HCO3-发生水解程度大于电离程度,而且溶液中还存在水电离产生OH-,所以c(OH)>c(CO32),C错误;
H2CO3+OH-,所以c(Na+)>c(HCO3);HCO3-发生电离作用产生c(CO32),HCO3-发生水解程度大于电离程度,而且溶液中还存在水电离产生OH-,所以c(OH)>c(CO32),C错误;
D.浓度均为0.lmol/L的CH3COOH与CH3COONa溶液等体积混合后,pH=5,说明CH3COOH的电离作用大于CH3COO-的水解作用,c(H+)=1×10-5mol/L,c(OH-)=1×10-9mol/L ,根据物料守恒可知:c(CH3COO-)+ c(CH3COOH)=2c(Na+);根据电荷守恒可知:c(CH3COO-) +c(OH-) = c(Na+)+c(H+),将两个式子叠加,可得c(CH3COO-) +2c(OH-) = c(CH3COOH)+2c(H+),将两式叠加可得:c(CH3COO-) +2c(OH-) = c(CH3COOH)+2c(H+),所以c(CH3COO-)-c(CH3COOH)=2[ c(H+)- c(OH-)]=2×(10-5-10-9) mol/L,D正确;
故合理选项是D。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】高纯氧化铝可用于制高压钠灯的陶瓷管。实验室制取高纯氧化铝的流程如下:
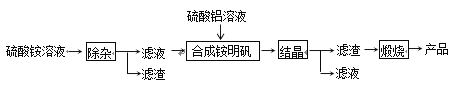
回答下列问题:
(1)硫酸铵溶液显酸性的原因是(用离子方程式表示)______________________________
(2)“除杂”操作是向硫酸铵溶液加入适量过氧化氢,再用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。该过程中,在酸性溶液条件下过氧化氢将Fe2+氧化成Fe3+的离子方程式为 _________________________,检验Fe2+已除尽的实验操作和现象是_______________________________
(3)通常条件下,若KSP[Fe(OH)3]=4.0×10-38,则理论上计算流程中“除杂”后溶液中c(Fe3+)等于____________mol·L-1
(4)配制硫酸铝溶液时,需用硫酸酸化,目的是__________________________________
(5)“结晶”操作中,母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到铵明矾晶体(NH4Al(SO4)2·12H2O);该操作过程中,母液不能蒸干的原因是_________________________
(6)向铵明矾溶液中滴加极少量NaOH溶液时,反应的离子方程式是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
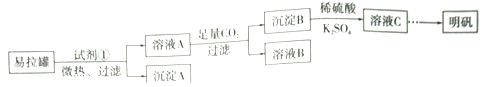
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
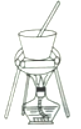
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入少量下列物质,下列判断正确的是
A. 加入NH4HSO4固体,v(H2)不变 B. 加入KNO3固体,v(H2)不变
C. 加入CH3COONa固体,v(H2)减小 D. 滴加CuSO4溶液,v(H2)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列有关问题
(1)KW的数学表达式是KW =__________,温度升高KW的变化情况是______(选填“变大”“变小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越________,对于反应2NO2(g) ![]() N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性_______,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Kα的变化情况是________(选填“变大”“变小”或“不变”)
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的__________。
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为_____________。(已知HNO2的电离常数Ka=7.1×104 mol/L,CH3COOH的电离常数为:Ka=1.7×105 mol/L),可使溶液A和溶液B的pH相等的方法是_____________。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学的叙述正确的是

A. 镀锌的铁皮镀层破损后,铁更容易腐蚀
B. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率增大
D. 如图对海水中的铁闸门进行电化学防护的方法是牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项反应对应的图像正确的是
A. 保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
保持温度不变,向BaSO4饱和溶液中加入硫酸钠固体
B. 向少量氯化铁溶液中加入铁粉
向少量氯化铁溶液中加入铁粉
C. 25℃时,向亚硫酸溶液中通入氯气
25℃时,向亚硫酸溶液中通入氯气
D. 向NaAlO2溶液中通入HCl气体
向NaAlO2溶液中通入HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是

A. 用图1装置验证化学能转化为电能
B. 用图2装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3装置制备氢氧化亚铁
D. 用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com