
 元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )
元素周期表前四周期的五种元素R、X、T、Z、Q在周期表中的相对位置如图所示,其中T单质在常温下为气态,Q单质在常温下为液态,则下列判断正确的是( )| A. | 原子半径及离子半径:X>T | |
| B. | R、T、Q的氢化物的热稳定性和还原性均依次减弱 | |
| C. | 相同物质的量的T、Z的单质的质量中Z的大 | |
| D. | T的非金属性比X的非金属性强,因此T的含氧酸的酸性比X的含氧酸的酸性强 |
分析 T单质在常温下为气态,Q单质在常温下为液态,则T为Cl,Q为Br,结合元素R、X、T、Z、Q在元素周期表中的相对位置,可知R为F、X为S、Z为Ar,结合元素周期律解答.
解答 解:T单质在常温下为气态,Q单质在常温下为液态,则T为Cl,Q为Br,结合元素R、X、T、Z、Q在元素周期表中的相对位置,可知R为F、X为S、Z为Ar,
A.同周期从左向右原子半径减小,原子半径:X>T,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为X>T,故A正确;
B.R、T、Q的非金属性减弱,则氢化物的热稳定性减弱,而还原性依次增强,故B错误;
C.相同物质的量的T、Z的单质的质量中T的大,因T为氯气,为双原子分子,相对分子质量大,故C错误;
D.T的非金属性比X的非金属性强,因此T的最高价含氧酸的酸性比X的含氧酸的酸性强,故D错误;
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质及元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在汽车排气管上加装“催化转化器”可以减少有害气体的排放 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物“,PM2.5在空气中有可能形成胶体 | |
| D. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗胃酸药物使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向葡萄糖溶液中加入足量NaOH溶液后,再加入新制氢氧化铜悬浊液,加热,可观察到产生黑色沉淀 | |
| B. | 向米汤中加入含碘的食盐,观察是否有颜色的变化,检验含碘食盐中是否含碘酸钾 | |
| C. | 向淀粉溶液中加入稀硫酸,加热后再用NaOH溶液中和并做银镜反应实验,检验淀粉是否水解 | |
| D. | 向油脂中加入NaOH溶液再蒸馏,提纯油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L | |
| B. | 常温常压下,2.8g的乙烯和丙烯的混合气体中含碳碳双键的数目为0.1NA | |
| C. | 常温下1 L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目均为0.5NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
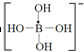 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

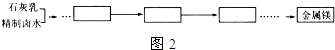
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com