
【题目】为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
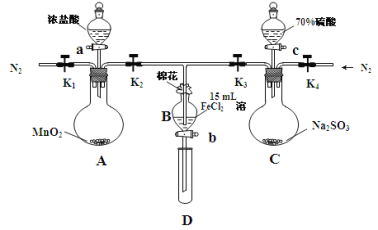
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_______________________________________________。
(2)棉花中浸润的溶液化学式为_________________________。
(3)A中发生反应的化学方程式为____________________________________。
(4)过程Ⅳ中检验其中Fe3+ 和Fe2+的试剂分别为___________和__________。
确定有Fe3+ 和Fe2+现象分别是_______________和____________________。
(5)过程Ⅵ,检验B溶液中是否含有SO42—的操作是_____________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:
过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO |
乙 | 既有Fe3+又有Fe2+ | 有SO |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
Cl2 > Fe3+ > SO2的是________(填“甲”“乙”“丙”)。
【答案】排除装置中的空气,防止干扰 NaOH溶液MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O硫氰化钾铁氰化钾溶液变红出现蓝色沉淀向D试管中加入适量盐酸,再加BaCl2溶液,若有白色沉淀产生,说明溶液中含有SO42—乙、丙
MnCl2 + Cl2↑+ 2H2O硫氰化钾铁氰化钾溶液变红出现蓝色沉淀向D试管中加入适量盐酸,再加BaCl2溶液,若有白色沉淀产生,说明溶液中含有SO42—乙、丙
【解析】
试题(1)空气中的氧气也能氧化亚铁离子为铁离子,所以通入氮气的目的是排除装置中的空气,防止干扰;
(2)氯气有毒,不能排放到空气中污染空气,所以用沾有NaOH溶液的棉花堵塞T型导管,防止氯气逸出;
(3)A装置是制取氯气的反应,化学方程式为MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O;
MnCl2 + Cl2↑+ 2H2O;
(4)根据离子的特征反应,过程Ⅳ中检验其中Fe3+和Fe2+的试剂分别为硫氰化钾和铁氰化钾,铁离子遇硫氰化钾溶液变红,亚铁离子遇铁氰化钾生成蓝色沉淀;
(5)D试管中可能含有亚硫酸根离子,所以检验硫酸根离子需除去亚硫酸根离子,具体操作为向D试管中加入适量盐酸,再加BaCl2溶液,若有白色沉淀产生,说明溶液中含有SO42-;
(6)甲的结论:IV中B溶液含有铁离子说明氧化性Cl2 > Fe3+ ,VI中B溶液含有硫酸根离子,若B溶液中氯气有剩余,则氯气会氧化二氧化硫生成硫酸根离子,不能判断氧化性Fe3+ > SO2;乙的结论:IV中B溶液含有Fe3+和Fe2+,说明氧化性Cl2 > Fe3+ 且氯气不足,所以VI中B溶液含有硫酸根离子,则一定是Fe3+氧化二氧化硫为硫酸根离子,所以判断氧化性Fe3+ > SO2,因此可得氧化性Cl2 > Fe3+ > SO2的结论;丙的结论:IV中B溶液含有铁离子说明氧化性Cl2 > Fe3+ ,VI中B溶液含有Fe2+,若是氯气氧化二氧化硫,不会有Fe2+生成,说明铁离子与二氧化硫发生氧化还原反应,Fe3+被还原为Fe2+,所以氧化性Fe3+ > SO2,因此可得氧化性Cl2 > Fe3+ > SO2的结论,所以能够证明氧化性: Cl2 > Fe3+ > SO2的是乙、丙。


科目:高中化学 来源: 题型:
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是________,发生反应的离子方程式为________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是______________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A. -Y kJ·mol-1 B. -(5X-0.5Y)kJ·mol-1
C. -(10X-Y)kJ·mol-1 D. +(10X-Y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
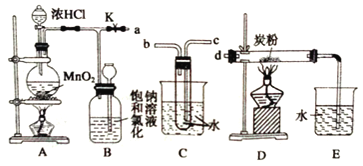
(1)A中圆底烧瓶内发生反应的离子方程式:_____________________________________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___________________________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42-、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3-、NO3-
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32-
D. 常温下AG=lg![]() =12的溶液中:Na+、K+、S2O32-、SO42-
=12的溶液中:Na+、K+、S2O32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g·cm-3)配制80mLlmol·L-1的稀硫酸。现给出下列仪器(配制过程中可能用到):①25mL量筒 ②l0mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒⑧80mL容量瓶 ,按使用仪器的先后顺序排列正确的是
A. ②⑥③⑦⑤⑥ B. ①⑤⑦⑥
C. ①③⑧⑥⑦ D. ④③⑦⑧⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是

A. 反应物微粒是S、SO3-、OH-
B. 该反应说明S2-和SO32-可以在碱性溶液中可以大量共存
C. 氧化剂与还原剂的物质的量之比为1:2
D. 3molS参加反应时,转移的电子数3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
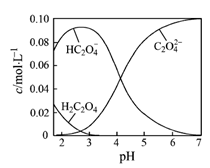
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com